
题目列表(包括答案和解析)
22、(6分)有甲、乙两份体积均为1L浓度为0.1 mol·L-1 的氨水,其pH为11。
(1)甲用蒸馏水稀释100倍,则NH3·H2O的电离平衡向 (“促进”或“抑制”),电离的方向移动,溶液的pH将为 (填序号)。
A.9-11之间 B.11 C.12-13之间 D.13
(2)乙与等体积浓度为0.2 mol·L-1的HCl混合,则混合溶液中,n(NH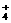 )+n(H+)-n(OH-)
)+n(H+)-n(OH-)
= mol。
21.(13分)现有A、B、C、D、E五种盐溶液,分别由K+、NH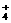 、Ag+、Ba2+、Al3+、Cl-、Br-、CO
、Ag+、Ba2+、Al3+、Cl-、Br-、CO 、SO
、SO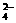 、NO
、NO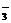 中的阳离子和阴离子各一种组成 (五种盐所含阴、阳离子各不相同)。已知:
中的阳离子和阴离子各一种组成 (五种盐所含阴、阳离子各不相同)。已知:



 ①A+B 白↓②A+C 白↓③A+D 白↓④B+C 白↓和一种气体⑤A的溶液呈中性⑥B的溶液中c(OH-)>c(H+)
①A+B 白↓②A+C 白↓③A+D 白↓④B+C 白↓和一种气体⑤A的溶液呈中性⑥B的溶液中c(OH-)>c(H+)
(1)C、D、E三种溶液的pH<7,根据以上实验事实可以推出(用化学式表示)A ,B ,C ,D ,E 。
(2)写出下面各步反应的离子方程式:
①
②
③
④
20. (7分)三氯化铁是中学化学实验室中必不可少的重要试剂。某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备FeCl3·6H2O,该同学设计的实验装置如图3所示,A中放有废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,从分液漏斗内向A中滴加过量盐酸,此时溶液呈浅绿色,再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使多余HNO3分解,再降温结晶得FeCl3·6H2O晶体。
(7分)三氯化铁是中学化学实验室中必不可少的重要试剂。某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备FeCl3·6H2O,该同学设计的实验装置如图3所示,A中放有废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,从分液漏斗内向A中滴加过量盐酸,此时溶液呈浅绿色,再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使多余HNO3分解,再降温结晶得FeCl3·6H2O晶体。
填写下列空白:
(1)从B导管收集产生的气体可采用的方法是 。
(2)滴加盐酸时,发现反应速率较之盐酸与纯铁粉反应要快,其原因是 。 图3
(3)烧杯内放过量稀HNO3的原因是 ,离子方程式是 。
(4)整个实验过程中,弹簧夹a都必须打开,除了为排出产生的气体外,另一个目的是 。
(5)用降温结晶法制得FeCl3·6H2O,而不用直接蒸干的方法来制得晶体的理由是 。
19. (12分)根据如图2所示A D的实验装置和试剂进行实验,试剂:①盐酸 ②溴水③亚硫酸钠 ④FeS ⑤CuSO4 ⑥品红溶液
(12分)根据如图2所示A D的实验装置和试剂进行实验,试剂:①盐酸 ②溴水③亚硫酸钠 ④FeS ⑤CuSO4 ⑥品红溶液
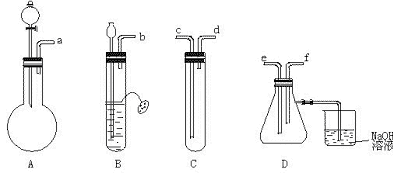
图2
(1)装置A主要是由仪器 组装起来的。
(2)要制取SO2气体,证明它既有氧化性又具还原性,并组装一套装置:
 (Ⅰ)按实验连接的顺序,把a f各导管口连接起来a→
(填接口序号)。
(Ⅰ)按实验连接的顺序,把a f各导管口连接起来a→
(填接口序号)。
 (Ⅱ)上述A C装置中,放入的试剂是A
,B
,C (填序号)。
(Ⅱ)上述A C装置中,放入的试剂是A
,B
,C (填序号)。
(Ⅲ)表现SO2还原性的实验是在 装置中,现象是 。
(Ⅳ)表现SO2氧化性的实验是在 装置中,现象是 。
(Ⅴ)D装置连接的烧杯中NaOH溶液的作用是 。
18.将KCl和CrCl3两种固体混合物共熔制得化合物X,X由K、Cr、Cl元素组成,将1.892 g X中的Cr全部氧化成Cr2O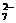 ,Cr2O
,Cr2O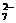 可从过量的KI溶液中氧化出2.667 g I2,反应的离子方程式是:Cr2O
可从过量的KI溶液中氧化出2.667 g I2,反应的离子方程式是:Cr2O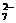 +6I-+14H+====2Cr3++3I2+7H2O。如果取溶有1.892 g X的溶液,加入过量的AgNO3溶液,可得4.52
g
AgCl沉淀,则表示X组成的化学式为
+6I-+14H+====2Cr3++3I2+7H2O。如果取溶有1.892 g X的溶液,加入过量的AgNO3溶液,可得4.52
g
AgCl沉淀,则表示X组成的化学式为
A.K3Cr2Cl7 B.K3Cr2Cl5 C.K3Cr2Cl9 D.K2CrCl4
第Ⅱ卷(非选择题 共76分)
17.某温度下,反应N2O4(g) 2NO2(g)-Q在密闭容器达到平衡,平衡时改变外界条件,使反应再次平衡,新平衡时,c(NO2)/c(N2O4)与原平衡相比变小了,则改变的条件可能是
2NO2(g)-Q在密闭容器达到平衡,平衡时改变外界条件,使反应再次平衡,新平衡时,c(NO2)/c(N2O4)与原平衡相比变小了,则改变的条件可能是
①保持容器容积和温度不变,向容器内补充了NO2
②保持容器容积和温度不变,向容器内补充了N2O4
③保持温度压强不变,向容器内补充了N2
④保持容器的容积不变,升高了温度
A.只有② B.只有③ C.①② D.①②③
16.出土的木制文物处于水饱和状态,出土后经其自然干燥后将失水变形,保护出土木制文物的一种方法是:将94.8 kg K2SO4·Al2(SO4)3·24H2O[K2SO4·Al2(SO4)3的相对分子质量:516]和4.2 kg水混合加热至90 ℃制成饱和溶液,并继续加热到92-95 ℃,将出土木制文物浸渍其中,待明矾溶液充分渗入,并取代木制文物水分后,趁热将文物从明矾溶液中取出,冷却至室温,明矾在木制文物中结晶,再在文物外部涂抹一层亚麻油,可保护出土木制文物。从以上所述事实中可知K2SO4·Al2(SO4)3 90 ℃时在水中的溶解度是
A.107.05 g B.119.49 g C.108.86 g D.94.89 g
15.下列各物质的稀溶液,不用其他任何试剂,仅用试管及胶头滴管通过相互反应不能区别的组是
A.FeCl3 AgNO3 Ba(OH)2 BaCl2
B.NaHSO4 MgSO4 Na2CO3 NaOH
C.KCl NaNO3 NH3·H2O HNO3
D.NaNO3 Na2CO3 BaCl2 HCl
14.常温下,0.1 mol·L-1的一元酸HA溶液,其pH>1,而0.1 mol·L-1的一元碱BOH溶液中c(OH-)/c(H+)=1012 ,将两种溶液等体积混合后,所得溶液中离子浓度大小关系正确的是
A.c(OH-)>c(H+)>c(B+)>c(A-)
B.c(B+)>c(A-)>c(H+)>c(OH-)
C.c(B+)>c(A-)>c(OH-)>c(H+)
D.c(A-)>c(B+)>c(H+)>c(OH-)
13.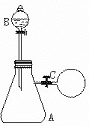 如图1所示,在支管锥形瓶A中充满等体积的H2S和NO气体;在分液漏斗B中盛有碘化钾溶液;在锥形瓶的支管处用橡胶管连接一个盛有O2的气囊C(与锥形瓶的体积约相等),用铁夹夹紧。当加入碘化钾溶液后,再打开铁夹并震荡锥形瓶,下列各化学方程式肯定不符合化学事实的是
如图1所示,在支管锥形瓶A中充满等体积的H2S和NO气体;在分液漏斗B中盛有碘化钾溶液;在锥形瓶的支管处用橡胶管连接一个盛有O2的气囊C(与锥形瓶的体积约相等),用铁夹夹紧。当加入碘化钾溶液后,再打开铁夹并震荡锥形瓶,下列各化学方程式肯定不符合化学事实的是
A.2NO+O2====2NO2
B.2H2S+3O2====2SO2+2H2O
C.2KI+2NO2====2KNO2+I2
D.H2S+HNO3====HNO2+S↓+H2O 图1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com