
题目列表(包括答案和解析)
3.B Na2SeO3类比于Na2SO3,Na2SO3易被氧氧化成Na2SO4,同理Na2SeO3可清除体内活性氧充当还原剂。
根据电子转移守恒有:
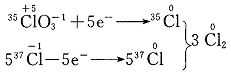
取生成的Cl23 mol,其中必含1 mol 35Cl和5 mol 37Cl,则氯气的相对分子摩尔质量为: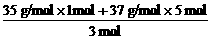 =73.3 g/mol,氯气的相对分子质量为73.3,故选D。
=73.3 g/mol,氯气的相对分子质量为73.3,故选D。
2.B
26.(10分)有碳原子数均不大于4的两种链状饱和一元醇0.3 mol,其质量为13.8 g。完全燃烧0.4 mol此混合物所生成的二氧化碳和水的物质
的量比反应前混合醇与氧气物质的量之和增加0.4 mol。求这两种醇的分子式、结构简式和物质的量之比。
高考统一标准测试化学试验(二)答案
25.(8分)用质量分数为98%浓H2SO4(密度为1.8 g· cm-3)配制1∶5 H2SO4 500 mL(密度为1.2 g·cm-3),应取质量分数为98%的浓H2SO4多少mL? 配制的1∶5 H2SO4溶液的质量分数和物质的量的浓度各是多少?
24.(8分)“柯达尔”是一种高聚物,其结构式为
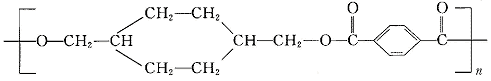
已知在一定条件下可以发生如下反应:
工业上以石油产品对二甲苯为原料合成“柯达尔”的方案如下
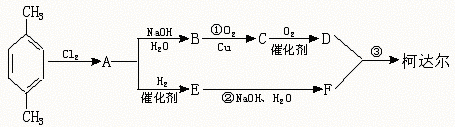
回答以下问题:
(1)写出结构简式:B D E ;
(2)写出化学方程式:B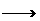 C
C
E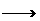 F
F
(3)D+F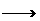 柯达尔(反应类型
)
柯达尔(反应类型
)
23.(12分)在国际环境问题中,一次性使用的聚苯乙烯材料所带来的“白色污染”问题甚为突出。中国杨凌农业科技开发区某公司已开发出60天自行降解功能的绿色包装材料聚乳酸(分子组成可表示为C3nH4n+2O2n+1)
(1)聚苯乙烯材料会造成“白色污染”,是因为 。
(2)乳酸是以淀粉为原料水解成葡萄糖,再经乳酸菌发酵制得:
|
 2C3H6O3 。为测定乳酸的分子结构,取9.0 g乳酸进行了如下的实验:
2C3H6O3 。为测定乳酸的分子结构,取9.0 g乳酸进行了如下的实验:
①跟NaOH反应,消耗了1.0 mol·L-1的NaOH溶液100 mL。由此说明 。
②跟足量的金属钠反应,放出气体240 mL(标准状况下)。由此说明 。
③以银为催化剂跟O2反应,生成物为CH3COCOOH。由此说明 。
因此,乳酸分子的结构简式为 。
(3)试写出两个乳酸分子间反应生成C6H8O4的化学方程式(有机物用结构简式表示,以下同) 。
(4)试写出乳酸分子间通过 反应,生成聚乳酸的化学方程式 。
(5)聚乳酸材料废弃后,首先水解成单体,然后在微菌作用下分解成二氧化碳和水。试写出这两步反应的化学方程式 。
得分评卷人
22.(12分)在一定条件下(不需要添加别的反应物),经不同的化学反应,可实现如下图的各种反应。其中,反应③、④、⑤属氧化还原反应,而反应
①、②属非氧化还原反应。X、F和Y为单质,且F是空气的主要组成成分之一,其余为化合物,据此请填空:
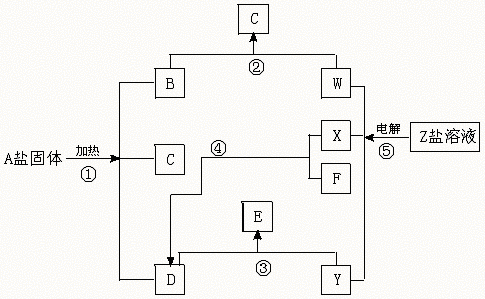
(1)物质A是 ,F是 ,X是 ,Y是 。
(2)写出反应②的化学方程式 。
(3)写出反应④的化学方程式,并注明反应条件 。
21.(8分)在10 ℃和2×105
Pa条件下,反应aA(g) dD(g)+eE(g)建立平衡后,再逐步增加体系的压强(保持温度不变)。下表列出不同压强 下反应建立平衡时物质D的浓度:
dD(g)+eE(g)建立平衡后,再逐步增加体系的压强(保持温度不变)。下表列出不同压强 下反应建立平衡时物质D的浓度:
|
压强/Pa |
2×105 |
5×105 |
1×106 |
|
D的浓度/mol·L-1 |
0.085 |
0.20 |
0.44 |
根据表中数据回答下列问题:
(1)压强2×105 Pa增加到5×105 Pa时,平衡向反应方向 移动(填“正”或“逆”),其理由是 。
(2)压强从5×105 Pa增加到1×106 Pa时,平衡向 反应方向移动(填“正”或“逆”),其理由是 。
20.(12分)“套管实验”是将一支较小的玻璃仪器装入另外一个玻璃仪器中,经组装来完成原来需要两只或更多普通玻璃仪器进行的实验。因其
具有许多优点,近年被广泛开发并应用于化学实验中,下述两个实验均为“套管实验”,请观察实验装置,分析实验原理,回答下列问题:
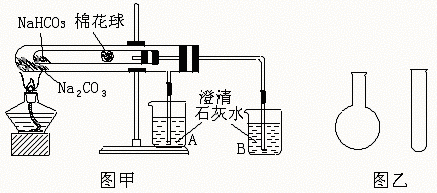
实验一:如图甲,小试管内塞有沾有无水硫酸铜粉末的棉花球。
(1)从点燃酒精灯开始,试管及烧杯A、B中能观察到的现象有 。
(2)整个实验结束时,在操作上需要特别注意的问题是 。
(3)通过该实验可以得出的结论是 。
实验二:在氨气的喷泉实验中,将圆底烧瓶集满氨气的操作很麻烦。请设计一个简单的操作方法,只用一支试管(如图乙),选用下列药品:A.氯化铵固体,B.氢氧化钠固体,C.浓氨水,D.浓硫酸,E.湿润的红色石蕊试纸,采用“套管法”在圆底烧瓶中集满喷泉实验的氨气。
(4)所用的试剂为 。
(5)请简述所设计的操作及判定集满氨气的现象: 。
(6)产生氨气的化学反应方程式为 。
(7)将上述两个实验与普通实验相比较,“套管实验”明显具备的优点是 。
19.(8分)设计实验,鉴定明矾\[KAl(SO4)2·12H2O\]的成分。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com