
题目列表(包括答案和解析)
6.向某无色透明溶液中滴加甲基橙溶液后呈红色,在该溶液中能够大量共存的离子组是
A.K+、Na+、Fe3+、NO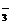
B.NH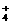 、Mg2+、K+、SO
、Mg2+、K+、SO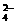
C.Ca2+、Ba2+、NO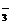 、Cl-
、Cl-
D.Ba2+、Zn2+、CH3COO-、Cl-
5.用0.1 mol·L-1 NaOH溶液滴定0.1 mol·L-1盐酸,如达到滴定的终点时不慎多加了1滴NaOH溶液(1滴溶液的体积约为0.05 mL),继续加水至50 mL,所得溶液的pH是
A.4 B.7.2 C.10 D.11.3
4.室温下用0.1 mol·L-1 NaOH溶液滴定a mL某浓度的HCl溶液,达到终点时消耗NaOH溶液b mL,此时溶液中氢离子的浓度c(H+)/mol·L-1是
A.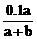 B.
B.
C.1×107 D.1×10-7
3.下图是向100 mL的盐酸中逐渐加入NaOH溶液时,溶液的pH变化图。根据图所得结论正确的是
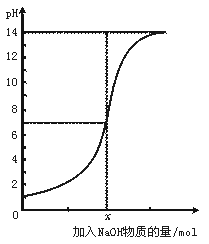
A.原来盐酸的物质的量浓度为0.1 mol·L-1
B.x处为0.1 mol的NaOH溶液
C.原来盐酸的物质的量浓度为1 mol·L-1
D.x处为0.01 mol的NaOH溶液
2.有一支50 mL酸式滴定管,其中盛有溶液,液面恰好在10.0 mL刻度处,把滴定管中的溶液全部流下排出,承接在量筒中,量筒内溶液的体积
A.大于40.0 mL B.为40.0 mL
C.小于40.0 mL D.为10.0 mL
1.(2003年春季高考理综题)以上是几种酸碱指示剂变色的pH范围:①甲基橙3.1-4.4 ②甲基红4.4-6.2 ③酚酞8.2-10,现用0.1000 mol·L-1 NaOH溶液滴定浓度相近的甲酸时,上述指示剂
A.都可以用 B.只能用③
C.可以用①或② D.可以用②或③
15.(5分)关于“电解氯化铜溶液时的pH变化”问题,化学界有以下两种不同的观点:
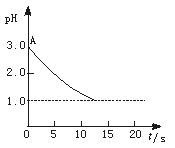
pH与时间关系图
观点一是:“理论派”认为电解氯化铜溶液后溶液的pH升高。
观点二是:“实验派”经过反复、多次、精确的实验测定,证明电解氯化铜溶液时pH的变化如图曲线的关系。
请回答下列问题:
(1)电解前氯化铜溶液的pH处在A点位置的原因是 (用离子方程式说明)。
(2)“理论派”所持观点的理论依据是 。
(3)“实验派”的实验结论是 。他们所述“精确实验”是通过 确定的。
(4)你持何种观点?你所持观点的理由是 (从化学原理加以简述)。
14.(8分)电池在人们的日常生活、工农业生产、教学科研等各个方面具有广泛的应用。电池按不同的划分标准可以划分为不同的种类,应用最广泛的是电化学电池。
(1)电化学电池能够把 能转化为 能。电化学电池的工作原理是 的迁移扩散和电化学反应。下列属于电化学电池的有 。
①蓄电池 ②锌锰电池 ③充电电池 ④一次性电池
(2)电化学电池的组成可以表示为:(-)负极材料‖A‖正极材料(+)。A表示 ,离子在A中的电阻比电子在金属中的电阻 。对于不漏电的电池电子在A中的电阻为 。
(3)1991年Sony公司首次推出商品化的锂离子电池,此后锂离子电池的厂家如雨后春笋般在全世界出现,锂离子电池的品种和数量也在逐年增加。锂离子电池的电压高,单个电池的电压是3.6 V,锂离子电池的正极材料是锂的过渡金属氧化物(例如LiCoO2)混以一定量的导电添加物(例如C)构成的混合导体,负极材料是可插入锂的碳材料。
①锂在元素周期表中位于第 周期,第 主族。
②锂离子电池所用的正负极材料都是不污染环境的无毒无害物质,属于绿色能源。而镉镍在生产过程中污染环境。(作为密封电池无毒无害可以放心使用)镉镍电池的有毒物质是 ,它作为电池的 极。
13.(12分)下表数据是在某高温下,金属镁和镍分别在氧气中进行氧化反应时,在金属表面生成氧化薄膜的实验记录:
|
反应时间t/h |
1 |
4 |
9 |
16 |
25 |
|
MgO层厚y/nm |
0.05a |
0.20a |
0.45a |
0.80a |
1.25a? |
|
NiO层厚y′/nm |
B |
2b |
3b |
4b |
5b |
注:a和b均为与温度有关的常数。?
请填空回答:
(1)金属高温氧化腐蚀速率可以用金属氧化膜的生长速率来表示,其理由是 。
(2)金属氧化膜的膜厚y跟时间t所呈现的关系是(填“直线”“抛物线”“对数”或“双曲线”):MgO氧化膜厚y属 型,NiO氧化膜厚y′属 型。
(3)Mg与Ni比较,哪一种金属更具有耐腐蚀性 ,其理由是 。
12.(10分)(1)今有反应2H2+O2 2H2O构成了燃料电池,则负极通的应是
,正极通的应是
。电极反应式为:负极
,正极:
。
2H2O构成了燃料电池,则负极通的应是
,正极通的应是
。电极反应式为:负极
,正极:
。
(2)如把KOH改为稀H2SO4做电解质,则电极反应式为:负极 ,正极 。两电极附近溶液的pH各有何变化?
(3)如把H2改为CH4、KOH做导电物质,则电极反应式为:负极 ,正极 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com