
题目列表(包括答案和解析)
20、(6分)在某条件下,容器中有如下平衡反应:A+4B≒2C+D+热量 此时A,B,C,的物质的量均为amol,而D的物质的量为dmol。
⑴改变a的取值,再通过改变反应条件,可以使批评重新达到平衡,并限定达到新的平衡时,D的物质量只允许在d/2到2d这间变化,则a的取值范围应是 (用a和d的关系式表示)。
⑵如果要使本反应重新建立和平衡中,D的物质的量只允许在d到2d之间取值,则应该采取的措施是 (从下面列出的选项中选择)。
A 升高反应温度 B 增大反应容器内之压强 C 增大反应容器容积
D 降低批评温度 E 减小反应容器内之压强 F 减小反应容器容积
19、(4分)已知气态氯化铝分子以双聚形式存在,其结构如下图所示:图中“Cl→Al”表示Cl原子提供
|
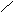



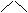
了一对电子与Al原子共享。又,已知硼酸H3BO3为白色固体,溶于水显弱酸性,但它却只是一元酸,可以用硼酸在水溶液中的电离平衡解释它只是一元弱酸的原因。请写出下面这个方程式右端的两种离子的表达式:
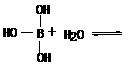
+
18、(10分)“卤块”的主要成分为MgCl2(含Fe2+、Fe3+、Mn2+等杂质离子),若以它为原料,按如下工艺流程图,即可制得“轻质氧化镁”。如果要求产品尽量不含杂质离子,而且成本较低,流程中所用试剂或pH值控制可参考下列附表确定。
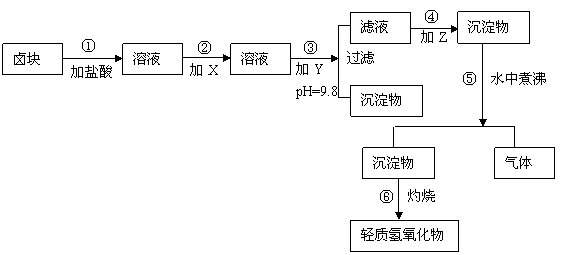
轻质氧化镁工艺流程图
表1 生成氢氧化物沉淀的值
|
物质 |
开始沉淀 |
沉淀完全 |
|
Fe(OH)3 Fe(OH)2 Mn(OH)2 Mg(OH)2 |
2.7 7.6 8.3 9.6 |
3.7 9.6Ω 9.8 11.1 |
Ω注:Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常将它氧化成为Fe3+,生成Fe(OH)3沉淀而去除之。
表2 化学试剂价格表
|
试剂 |
价格(元/ t ) |
|
漂液(含NaClO25.2%) H2O2(30%) NaOH(固98%) Na2CO3(固99.5%) 卤块(MgCl2,30%) |
450 2400 2100 600 310 |
请填写以下空白:
⑴在步骤②加入试剂X,最付佳选择应是 ,其作用是 。
⑵在步骤③加入的试剂Y应是 ,之所以要控制pH=9.8,其目的是 。
⑶在步骤⑤时发生的化学反应方程式是: 。
17、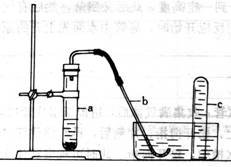 用示意图中的简易装置可以进行气体的发生和收集。
用示意图中的简易装置可以进行气体的发生和收集。
⑴实验前应如何检查该装置的气密性?答:
⑵拔开试管a的橡皮塞,加入10mL6mol/L稀硝酸和1g薄铜片,立即将带有导管的橡皮塞塞紧试管口。反应开始时速度缓慢,逐渐加快。请写出在试管a中所发生的所有反应的化学方程式。答;
⑶从反应中开始到反应结束,预期在试管a中可观察互哪些现象?依次逐一写出。答;
⑷在反应开始时,可观察到导管b中的水面先沿导管b慢慢一升到一定高度,此后又回落,然后有气泡从管回冒出。试说明反应开始时,导管中不面先上升的原因。答:
⑸试管c收集满气体后,用拇指堵住管口,取出水槽。将管口向上,松开拇指,片刻后,再次堵住管口,将试管又再倒置于水槽中,松开拇指,此时可观察到什么现象?答:
16、CaC2和ZnC2,Al4C3,Mg2C3,Li2C2等都同属离子型碳化物,请通过对CaC2制C2H2的反应进行思考,从中得到必要的启示,判断下列反应产物正确的是
A ZnC2水解生成乙烷(C2H6) B Al4C3水解生成丙炔(C3H4)
C Mg2C3水解生成丙炔(C3H4) D Li2C2水解生成乙烯(C2H4)
第Ⅱ卷
(共四大题,8小题,66分)
15、在一定条件下,全盛氨反应达到平衡后,混合气体中NH3的体积占25%。若反应前后条件保持不变,则反应后缩小的气体体积与原反应物体积的比值是
A 1/5 B 1/4 C 1/3 D 1/2
14、已知原子量:Li 6.9,Na 23,K 39,Rb 85。今有某碱金属M及其氧化物M2O组成的混合物10.8g,加足量水充分反应后,溶液经蒸发和干燥得固体16g。据此可确定碱金属M是
A Li B Na C K D Rb
13、在同温同压下,把等体积的空气和二氧化碳混合,并使之在高温下跟足量的焦炭反应。若氧气和二氧化碳最后全部转化为一氧化碳,则反应后气体中一氧化碳的体积分数约是
A 0.60 B 0.64 C 0.70 D 0.75
12、用0.01mol/LH2SO4滴定0.01mol/LNaOH溶液,中和后加水至100mL。若滴定时终点判断有误差;①多加了1滴H2SO4;②少加了1滴H2SO4(设1滴为0.05mL)。则①和②[H+]之比的值是
A 10 B 50 C 5×10 D 104
11、R2O8n-离子在一定条件下可以把Mn2+离子氧化为MnO4-,若反应后R2O8n-离子变为RO42-离子。又知反应中氧化剂与还原剂的物质的量之为5:2,则的值是
A 1 B 2 C 3 D 4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com