
题目列表(包括答案和解析)
20、(14分)某同学用如图所示的装置对铜粉(含碳)样品进行实验测定,请完成实验报告。
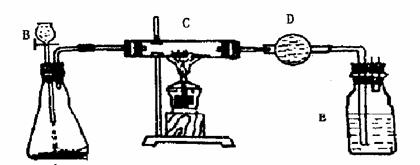
A
(1)实验目的:测定样品中铜的质量分数。
(2)实验用品:(请把上图中A、B、C等仪器的名称填入下列相应空格中)
仪器:天平,A ,B ,硬质玻璃管,D ,酒精灯,洗气瓶等;
药品:红褐色铜粉(含碳)样品,过氧化氢溶液,二氧化锰,碱石灰,浓硫酸等。
(3)实验步骤:
① 选仪器安装后,检查气密性;在C中加入样品粉末W;在D中装入药品后,称得质量为m1。
② 打开B的活塞,慢慢滴加溶液,在A中进行的化学反应方程式为:
。
③ 对C进行加热,当C中药品充分反应后,关闭B的活塞,停止加热,C中发生反应的方程式为 和 。
④ 冷却后,称量D的质量为为m2。
(4)计算:实验时,C中反应完全,D中吸收也完全,根据所得数据,样品中铜的质量分数= (用含W、m1、m2的代数式表示)。
(5)问题讨论:
① E中所盛试剂为 ,其作用是 。
② 根据上述实验方案测得铜的质量分数跟实际铜的质量分数相比,是偏高、偏低、还是相等? ,原因是 。
③ 如需要对该同学设计的实验装置进行改进,请提出改进的方案是 。
19、(8分)用滴管将新制的饱和氯水慢慢滴入含酚酞的NaOH稀溶液中,当滴到最后一滴时红色突然褪去。试回答下列问题:
(1)实验室保存饱和氯水的方法是 。
(2)产生上述现象的原因可能有两种(用简要文字说明):
① 是由于 ;
② 是由于 。
简述怎样用实验证明红色褪去原因是① 或者② : 。
18.为了更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG=lg{c(H+)/ c(OH-)},则下列叙述正确的是 ( )
A.中性溶液AG=0
B.酸性溶液AG<0
C.常温下0.1 mol•L-1的氢氧化钠溶液AG=12
D.常温下0.1 mol•L-1的盐酸溶液AG=12
高考化学模拟试题
化 学
第Ⅱ 卷(非选择题 共78分)
17.下列叙述中不正确的是 ( )
A.电解池的阳极上发生氧化反应,阴极上发生还原反应
B.用原电池做电源进行电解时,电子从电池负极流向电解池阳极
C.电镀时,电镀池里的阳极材料发生氧化反应
D.原电池的正极上发生氧化反应,负极上发生还原反应
16.某溶液中含Cl-、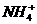 、H+和OH-四种离子,下列关于四种离子浓度大小的比较一定不正确的是
( )
、H+和OH-四种离子,下列关于四种离子浓度大小的比较一定不正确的是
( )
A.c(Cl-)>c(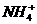 )>c (H+)>c (OH-) B.c(Cl-)>c(
)>c (H+)>c (OH-) B.c(Cl-)>c(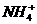 )=c (H+)>c (OH-)
)=c (H+)>c (OH-)
C.c(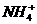 )>c(Cl-)>c (H+)>c
(OH-) D. c (
)>c(Cl-)>c (H+)>c
(OH-) D. c (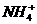 )>c(Cl-)>c (OH-)>c (H+)
)>c(Cl-)>c (OH-)>c (H+)
15.某有机物甲经氧化后得乙(分子式为C2H3O2Cl);而甲经水解可得丙,1mol丙和2mol乙反应得一种含氯的酯(C6H8O4Cl2);由此推断甲的结构简式为 ( )
A.ClCH2CH2OH B.OHC-O-CH2-Cl
C.ClCH2CHO D.HO-CH2-CH2-OH
14.向明矾溶液里滴入Ba(OH)2溶液,当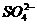 沉淀完全时,铝元素的存在形式是
沉淀完全时,铝元素的存在形式是
A.一部分为Al(OH)3沉淀,一部分以Al3+形式存在于溶液中
B.一部分为Al(OH)3沉淀,一部分以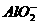 形式存在于溶液中
形式存在于溶液中
C.全部为Al(OH)3沉淀
D.几乎全部以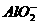 形式存在于溶液中
形式存在于溶液中
13.放热反应CO(g) + H2O(g)  CO2(g) + H2(g)在温度t1时达到平衡。c1(CO)=c1(H2O)=1.0mol•L-1,其平衡常数为K1。降低反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
CO2(g) + H2(g)在温度t1时达到平衡。c1(CO)=c1(H2O)=1.0mol•L-1,其平衡常数为K1。降低反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
A.K1 和K2的单位均为mol•L-1
B.K2<K1
C.c2(CO)=c2(H2O)
D.c1(CO) >c2(CO)
12. 下列各种环境中的离子组合能够大量共存的是
下列各种环境中的离子组合能够大量共存的是
A.pH=0的溶液:Al3+、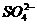 、Ca2+、
、Ca2+、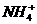
B.无色溶液:Mg2+、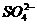 、Fe3+、Cl-
、Fe3+、Cl-
C.c(H+)=10-14 mol•L-1的溶液:S2-、Na+、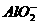 、
、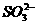
D.pH试纸变红的溶液:Fe2+、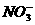 、I-、ClO-
、I-、ClO-
11.预防“非典”的措施之一为经常对居住、工作环境消毒,常用消毒剂过氧乙酸的
|
结构为 CH3 -C-O-O-H,下列叙述正确的是
-C-O-O-H,下列叙述正确的是
A.过氧乙酸具有强氧化性 B.过氧乙酸含有羧基
C.过氧乙酸具有酸性 D.过氧乙酸中氧显-2价
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com