
题目列表(包括答案和解析)
22.(12分)已知:D.E.F.K.L为气体,E能使澄清石灰水变浑浊,1是金属,1molA在反应①中转移的电子的物质的量为1mol,B.H是常见的化肥,它们有如下图所示转化关系(部分反应中生成的水已略去):试回答下列:
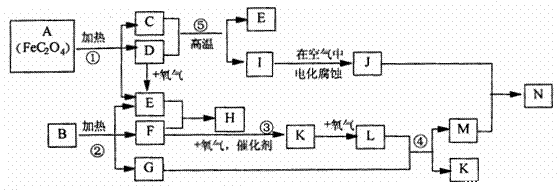 (1)写出化学方程式;C__________D _____________H ____________N
______________ (2)写出反应方程式
(1)写出化学方程式;C__________D _____________H ____________N
______________ (2)写出反应方程式
②___________________________ ③ ___________________________
④ ___________________________
(3)写出离子反应方程式 I+M-N+K:____________________________
21.(5分)两种元素的核外电子层数之比与最外层电子数之比相等,则在周期表的前18号元素中,满足上述关系的元素组合有(不一定填满):
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
元素符号 |
H.Be |
|
|
|
|
|
|
20.(16分)在实验室里制取某些有毒气体时,为了尽量防止毒气逸散造成空气污染,有人设计了如下图所示的装置[Ⅰ]。并设想用[Ⅱ]或[Ⅲ]两种简易装置代替[Ⅰ]的b-c部分,以求达到同样的目的。
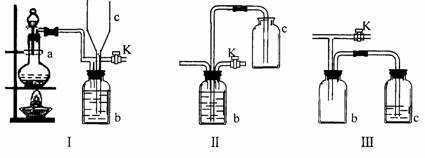
试回答:____________________________
(1)若用[Ⅰ]取氯气,b瓶加入的液体一般为 ______________。在选取试剂正确且适量的前题下,反应开始后,当关闭活塞K时如若发现c中液面不明显上升,你分析可能的原因是__________________________检查的简单方法是__________________________
(2)装置[1)中b能防止多余气体逸散的原因是:____________________________
(3)欲用[Ⅱ]或[Ⅲ]代替[Ⅰ]中的b-c部分(选用液体相同),是否可行?说明理由。
[Ⅱ]是否可行(填“是”或“否”) ______________ 理由是___________________________
[Ⅲ]是否可行(填“是”或“否”) _____________理由是______________
19.(7分)在0.5mol·L:纯碱溶液中滴入酚酞试液变红,若在该溶液中再逐滴滴入过量
BaCl2溶液,所观察到的现象是;其原因是(用离子反应方程式和简要文字说明):
_________________________________________________________
_________________________________________________________
18.某稀溶液中含有Fe(NO3)3 、Cu(NO3)2 、HN03,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如下图所示。则稀溶液中Fe(N03)3、Cu(NO3)2、HN03物质的量浓度之比为
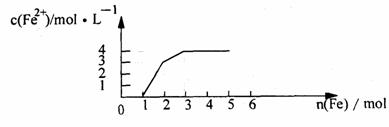
A.1:1:1 B.1:3:1 C.3:3:8 D.1:1:4
第Ⅱ卷(非选择题共78分)
17.经测定某溶液中只含NH4+、C1- 、H+、OH-四种离子,下列说法错误的是 ( )
A.溶液中四种粒子之间不可能满足:c(C1-)>c(H+)>c(NH4+)>c(OH-)
B.若溶液中粒子间满足:c(NH4+)>c(C1-)>c(OH-)>c(H+)则溶液中溶质一定为:NH4Cl和NH3·H20
C.若溶液中粒子间满足:c(C1-)>c(NH4+)>c(H+)>c(OH-)溶液中溶质一定只有NH4Cl
D.若溶液中c(NH4+)=c(Cl-),则该溶液一定显中性
16.硝酸铜是制备Cu-Zn-AI系催化剂的重要原料,制取硝酸铜现有三种设计方案可供选用
①Cu与稀硝酸反应制取,3Cu+8HN03=3Cu(NO)Q+2NO↑+4H20
②Cu与浓硝酸反应制取,Cu+4HN03=Cu(NO3)2+2N02↑+2H20
③通氧气于铜屑与稀硝酸的体系中制取,2Cu+4HN03+02=2Cu(N03)2+2H2O
下列说法不正确的是 ( )
A.制取相同量的硝酸铜需硝酸的量③最少
B.制取相同量的硝酸铜①产生的有毒气体比②少
C.三种方案中硝酸的利用率③>②>①
D.三种方案的反应都可以在铁制容器中进行
15.以NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.0.1molH3O+中含有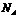 个电子
个电子
B.标准状况下,11.2L臭氧中含有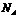 个氧原子
个氧原子
C.2g重氧水(H218O)、含有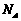 个中子
个中子
D.84gNaHC03晶体中含有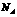 个CO32-
个CO32-
14.X和Y两元素的阳离子具有相同的电子层结构。K元素的阳离子半径大于Y元素的阳离子半径。Z和Y两元素的核外电子层数相同,Z元素的原子半径小于Y元素的原子半径。则X、Y、Z三种元素原子序数的关系是 ( )
A.X>Y>Z B.Y>X>2 C.Z>X>Y D.Z>Y>X
13.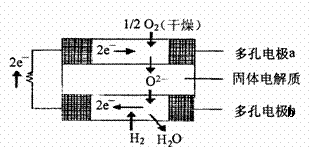 固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的。它以固体氧化锆一氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2- )在其间通过。该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是 ( )
固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的。它以固体氧化锆一氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2- )在其间通过。该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是 ( )
A.有O2参加反应的a极为电池的负极
B.有H:参加反应的b极为电池的正极
C.a极对应的电极反应式为O2+2H20-4e=40H-
D.该电池的总反应方程式为:2H2+02=2H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com