
题目列表(包括答案和解析)
1.发射宇宙飞船的运载火箭的推进剂引燃后,产生大量高温气体从尾部喷出,该气体主要
成分是CO2、H2O、N2、NO等,在发射现场可看到火箭尾部产生大量红色气体,其原因
是 ( )
A.高温下N2遇空气生成NO2 B.NO遇空气生成NO2
C.CO2与NO反应生成CO和NO2 D.NO与H2O反应生成H2和NO2
35、(9分)将amolH2S与一定量O2在一容积可变的密闭容器中混合点燃反应完毕后,已知O2无剩余,恢复至反应前的状况(1.01×105Pa,120℃)气体体积是反应前的b%,
(1)若b=70时,写出点燃后表示反应前后体积关系的化学方程式:
___________________________________________________
(2)b的取值范围:________________________
(3)若70≤b≤80,设参加反应的O2物质的量为mmol,则m的取值范围为_____________
(4)若燃烧后平均相对分子质量为26,参加反应的O2为mmol,则m值可能___________。
34、(6分)有一硫酸和硝酸的混合溶液,取出其中的10mL,加入足量BaCl2溶液可得白色沉淀9.32g,另取10mL这种溶液与4mol/L的NaOH溶液25mL恰好完全中和。
(1)混合溶液中,H2SO4和HNO3的物质的量浓度各是多少?
(2)再取10mL混和液与0.96g铜粉共热,将有多少mL气体产生(标准状况)?
33、(6分)1mol某饱和烃的含氧衍生物A与2molNaOH在一定条件下恰好完全作用生成1mol钠盐,A的相对分子质量不超过120,氧的质量分数不超过0.543,试回答下列问题:
(1)A的1个分子中含有_________个氧原子;
(2)A的化学式为_______________,
(3)A有多种同分异构体,其中有一种不能使石蕊试液变红,写出这种异构体与氢氧化钠溶液共热的化学方程式_____________________________________________
32、(6分)化合物A,学名邻羟基苯甲酸,俗名水杨酸,其结构为:
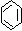 -OH
-OH
-COOH
(1)水杨酸的同分异构体中,属于酚类,同时还属于酯类的化合物有________(填写数字)种,其结构简式分别为__________________________
(2)水杨酸的同分异构体中,属于酚类,但是不属于酯类,也不属于羧酸类的化合物必定含有_________基(填写除了羟基以外的官能团名称)
31、(6分)在烃的分子结构中,若每减少2个氢原子,则碳碳间便增加一对共用电子,已知分子组成为CnH2n+2的烃分子中碳碳间的共用电子对数为(n-1),则分子式为CnH2n-2的烃分子中,碳碳间的共用电子对数为_____________;CX也可以看作烃减氢后的产物,则C60分子中碳碳间的共用电子对数为_______________;若某烃的分子式为CxHy,且知该烃分子中碳碳间共用电子对数为140,则x和y之间满足的关系为____________
30、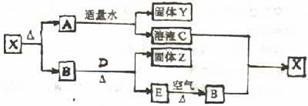 (6分)已知X是一种常见的白色固体,D、E是两种常见的固体单质,B是常见气体,现有如下转化关系:
(6分)已知X是一种常见的白色固体,D、E是两种常见的固体单质,B是常见气体,现有如下转化关系:
回答下列问题:
(1)写出X、Y的化学式:X________________Y________________
(2)B与D加热时发生反应的反应式为_________________________________
(3)过量B与溶液C发生反应的离子方程式为_______________________________
29、(6分)长期以来一直认为氟的含氧酸不存在,自1971年美国科学家用F2通过细冰末获得HFO(次氟酸)以来,对次氟酸的研究引起充分重视。
(1)制备次氟酸的反应式______________________________
次氟酸的电子式为________________________________
(2)次氟酸能与水反应得溶液A,A中含B、C两种溶质,B是一种极难被氧化的物质,C既有氧化性又有还原性,写出次氟酸与水反应的化学方程式
_____________________________________________________________________
(3)将溶液A滴入紫红色酸性高锰酸钾溶液中,紫红色褪去,有Mn2+生成,写出这一反应的离子方程式______________________________________________
28、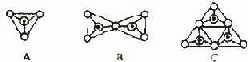 (5分)原硅酸根(SiO44-)中的硅原子被4个氧原子所包围,所以用图A来表示SiO44-的空间构型为____________,图B表示___________(写化学式)的空间构型,图C表示_______________(用化学式)的空间构型。
(5分)原硅酸根(SiO44-)中的硅原子被4个氧原子所包围,所以用图A来表示SiO44-的空间构型为____________,图B表示___________(写化学式)的空间构型,图C表示_______________(用化学式)的空间构型。
○:氧原子
●:硅原子
⊙:Si-O
27、(10分)已知甲酸(HCOOH)是羧酸中最简单的一种,它具有羧酸的性质,在实验室里常用甲酸在浓H2SO4的催化作用下制取少量一氧化碳,现用甲酸与甲醇反应制取甲酸甲酯来验证甲酸具有发生酯化反应的性质,装置如下图所示。
回答下列问题:
(1)制取甲酸甲酯反应的方程式为________________________________________
烧瓶中最可能发生的副反应为_________________________________________
(2)实验过程中选用的试剂及用品有:浓H2SO4、甲醇、甲酸还有________、_________两种物质。
(3)导管a不插入液面下的理由是______________________________________
长导管b的作用是_______________________________________________
在实验过程中导管b能否直接与大气相通,说明理由____________________
(4)大试管中溶液的作用有溶解甲醇,吸收甲酸,还有______________________________
(5)若大试管中溶液是氢氧化钠溶液,则收集到产物比预期的少,其原因是_____________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com