
题目列表(包括答案和解析)
2. 质量分数为a的某物质的溶液mg与质量分数为b的该物质的溶液ng混合后,蒸发掉pg水(没有晶体析出),得到的溶液每毫升质量为qg,物质的量浓度为c。则溶质的相对分子质量为

1. 设NA为阿伏加德罗常数,如果ag某气体的分子数为p,则bg该气体在标准状况下的体积V(L)是:

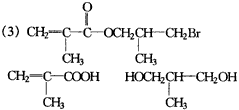

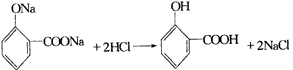
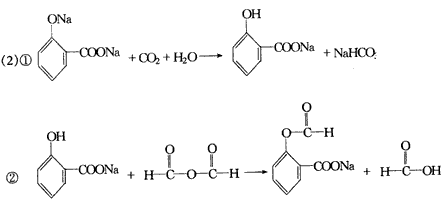
(2)①②③④⑤⑦ (3)
(4)5
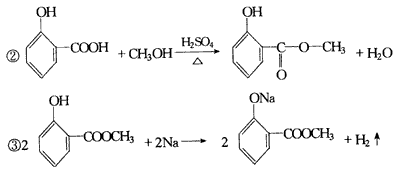
(2)氧化反应加成反应还原(加成)反应酯化反应 4.(1)CH3CH2CH2OH (2)
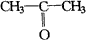
(3)CH3CH2COOCH(CH3)2
|
5.(1)① |
 |
Ⅳ.化学实验
1.(1)NO(2)稀硝酸;铜屑;蒸馏水(3)甲
(4)3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
(5)①铜片和稀硝酸反应,有无色气泡产生。②试管a上部空间由无色变为浅棕色,又变为无色。③试管a中的溶液由无色变成浅蓝色。④反应过程中,Cu片逐渐变小。
2.(1)3Fe+4H2O(气) Fe3O4+4H2↑
(2)CaCl2碱石灰n
(3)略(向下排空气法)
(4)试管口向下,用拇指堵住试管口,靠近火焰,松开拇指,能燃烧或发出爆鸣声,说明收集的是H2。
3.(1)MnO2+4H++2Cl-
Fe3O4+4H2↑
(2)CaCl2碱石灰n
(3)略(向下排空气法)
(4)试管口向下,用拇指堵住试管口,靠近火焰,松开拇指,能燃烧或发出爆鸣声,说明收集的是H2。
3.(1)MnO2+4H++2Cl- Mn2++Cl2+2H2O
(2)2Cl2+2H2O(气)+C
Mn2++Cl2+2H2O
(2)2Cl2+2H2O(气)+C 4HCl+CO2
吸收氯气中的HCl,提供D处反应所需的水蒸气
(3)先变红后退色
(4)瓶中液面下降,漏斗中液面上升贮存少量多余的氯气
(5)盐酸的浓度不断减小,到一定程度时将不再进行反应
(6)强碱Cl2+2OH-=Cl-+ClO-+H2O
4.(1)B,G
2KBr+2H2SO4+MnO2
4HCl+CO2
吸收氯气中的HCl,提供D处反应所需的水蒸气
(3)先变红后退色
(4)瓶中液面下降,漏斗中液面上升贮存少量多余的氯气
(5)盐酸的浓度不断减小,到一定程度时将不再进行反应
(6)强碱Cl2+2OH-=Cl-+ClO-+H2O
4.(1)B,G
2KBr+2H2SO4+MnO2 K2SO4+MnSO4+Br2↑+2H2O
或2KBr+4H2SO4+MnO2
K2SO4+MnSO4+Br2↑+2H2O
或2KBr+4H2SO4+MnO2 2KHSO4+Mn(HSO4)2+Br2↑+2H2O
(2)A,G2H2O2
2KHSO4+Mn(HSO4)2+Br2↑+2H2O
(2)A,G2H2O2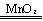 2H2O+O2↑
(3)①倒置的漏斗可以防止HBr溶于水产生倒吸,橡皮塞2接8增加了导管长度,起冷凝回流作用
②防止浓H2SO4氧化Br-
③NaOH溶液(或其他碱溶液)分液漏斗
5.(1)21
(2)K1、K2K3
(3)气球Q慢慢缩小
(4)平衡分液漏斗上下的压强使H2SO4顺利流下
(5)碱石灰控制气体流速,使CO2充分吸收
(6)78y/(53x+25y)
2H2O+O2↑
(3)①倒置的漏斗可以防止HBr溶于水产生倒吸,橡皮塞2接8增加了导管长度,起冷凝回流作用
②防止浓H2SO4氧化Br-
③NaOH溶液(或其他碱溶液)分液漏斗
5.(1)21
(2)K1、K2K3
(3)气球Q慢慢缩小
(4)平衡分液漏斗上下的压强使H2SO4顺利流下
(5)碱石灰控制气体流速,使CO2充分吸收
(6)78y/(53x+25y)
4.(1)①②③④⑤,这些反应有单质参加或有单质生成。(2)H2O2,SO2,H2S
H2O2+SO2=H2SO4
H2O2+H2S=S+2H2O
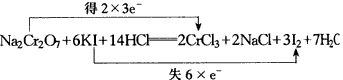
5.(1)①KHCO3 ②碳 (2)①4KO2+2CO2=2K2CO3+3O2
②产生同质量的氧气,需m(Na2O2)/m(KO2)=1∶0.6,应选KO2
6.①KBrO3>KIO3>Br2
②A.a≤1/6B.I2,Br-,Br2C.1/5≤a<6/5D.a≥6/5;IO3-,Br2③8/15
④I2:0.1molKIO3:0.8molBr2:0.5mol
7.(1)B,E
(2)NH34NH3+6NO=5N2+6H2O
(3)NO2-+Cu++2H+=NO↑+Cu2++H2O
(4)3NO N2O+NO2
2NO2
N2O+NO2
2NO2 N2O445<M<60
二、离子反应
1.B2.D
3.(1)Al2O3Fe2O3
(2)①Al3++3AlO2-+6H2O=4Al(OH)2↓
②Fe+2H+=Fe2++H2↑
③4Fe2++8NH3·H2O+O2+2H2O=4Fe(OH)3↓+8NH4+
4.(1)Al3++2SO42-+NH4++2Ba2++4OH-=Al(OH)3↓+2BaSO4↓+NH3·H2O
(2)600mL750mL
5.(1)2S2-+SO32-+6H+
N2O445<M<60
二、离子反应
1.B2.D
3.(1)Al2O3Fe2O3
(2)①Al3++3AlO2-+6H2O=4Al(OH)2↓
②Fe+2H+=Fe2++H2↑
③4Fe2++8NH3·H2O+O2+2H2O=4Fe(OH)3↓+8NH4+
4.(1)Al3++2SO42-+NH4++2Ba2++4OH-=Al(OH)3↓+2BaSO4↓+NH3·H2O
(2)600mL750mL
5.(1)2S2-+SO32-+6H+ 3S↓+3H2O
(2)Al3++3HCO3-
3S↓+3H2O
(2)Al3++3HCO3- Al(OH)3↓+3CO2↑
(3)BaCO3或BaCO3和BaSO4的混合物;加入足量的稀HNO3振荡,若沉淀全部溶解,只含BaCO3,若沉淀部分溶解,为二者混合物
(4)Na+,AlO2-,S2-,SO32-
三、物质结构
1.(1)4276028(2)动量(3)6
(4)基因突变X射线、紫外线、激光等
2.(1)同素异形体(2)C(3)5(4)是(5)?A.1,4,1,4?B.2/3
四、元素周期律和元素周期表
1.(1)F2
Al(OH)3↓+3CO2↑
(3)BaCO3或BaCO3和BaSO4的混合物;加入足量的稀HNO3振荡,若沉淀全部溶解,只含BaCO3,若沉淀部分溶解,为二者混合物
(4)Na+,AlO2-,S2-,SO32-
三、物质结构
1.(1)4276028(2)动量(3)6
(4)基因突变X射线、紫外线、激光等
2.(1)同素异形体(2)C(3)5(4)是(5)?A.1,4,1,4?B.2/3
四、元素周期律和元素周期表
1.(1)F2
|
(2) |
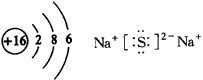 |
(3)砷两Z元素位于周期表中金属与非金属元素的分界线附近
2.(1)H3PO4(2)2种,5(3)P和O
3.(1)207 g·mol-1?
(2)六ⅣA
(3)2PbO·PbO2Pb2PbO4
(4)Pb3O4+8HCl(浓)=3PbCl2+Cl2↑+4H2O
4.(1)随原子序数增大,正值变小;周期性
(2)①③(3)419738
(4)该元素最外层电子排布已达到8个电子的稳定结构
五、物质的量有关计算
1.(1)BC(2)DA
2.(1)V(O2)=p2/p1
(2)无O
O21/4(p2-1.5p1)
H21/4(3p1-2p2)
3.c(Fe2+)=0.50mol·L-1?c(H+)=1.0mol·L-1?
4.(1)T℃和pPa下气体的密度为ag·L-1?
19.5g+11.0g-3.00L×ag·L-1?
(2)盐酸的浓度bmol·L-1? ①当0.48/24<0.01×b/2时,V(H2)=0.48/24×22.4(L) ②当0.48/24>0.01×b/2时,V(H2)=0.01×b/2×22.4(L)
六、化学反应速率和化学平衡
1.D2.B
3.(1)①3.0,逆②c>2/3a且b≤a或c>2/9b,且a≤b/3
(2)适当降温或加压降温或加压,平衡向正方向移动,气体总物质的量减小。
4.(1)短高
(2)逆向移动不移动
(3)不变增大
5.(1)αA=56
%αB=70%
(2)M=(5MA+2MB)/7
(3)反应前后压强不变
七、pH的有关计算
1.(1)100mL容量瓶
(2)>1,B
(3)配制pH=1的HA溶液难以实现,不妥之处在于加入锌粒难以作到表面积相同
(4)配制NaA溶液,测其pH>7,即证明HA为弱酸
2.(1)C(2)A,B(3)A(4)4.44×109
八、盐的水解
1.(1)>(2)>(3)=
2.(1)AD(2)CD(3)DA
3.(1)=(2)>(3)<
4.(1)A.0.1mol·L-1?醋酸B.0.1mol·L-1?氨水C.可能是HCl,NaCl,NaOH(2)A=B>C溶液中自由移动的离子浓度(3)0.1mol·L-1?NaOH溶液AB,NH4++Ac-+H2O NH3·H2O+HAC
九、酸碱中和滴定
1.(1)①未搅拌②未冷却即转移③未用玻棒引流④未用胶头滴管加水定容⑤未振荡、摇匀
(2)酸式“0”以下刻度
(3)碱式滴定管,锥型瓶甲基橙黄色橙色
(4)80 %(5)A,C,E
2.(1)碱式滴定管淀粉蓝色变为无色
(2)2S2O32-+I2=S4O62-+2I-
(3)0.06
(4)AB段表示温度降到B点即90K时,超导体YBa2Cu3O7-x??电阻为零。BC段表示自90K起,随温度升高,电阻逐渐增大
十、晶体
1.C2.C3.C,D4.B
5.(1)12(2)6(3)2
6.(1)68(2)3∶1∶1CaTiO3
(3)(a+b+3c)/NAd3×1021?
7.(1)C14H20?(2)C26H32?(3)4,4,四面体
十一、原电池及其应用
1.C2.C
3.(1)①由于c(H+)的变化使平衡向不同方向移动,发生不同方向的反应,电子移动方向不同
②2I--2e-=I2
(2)AsO33-+H2O-2e-=AsO43-+2H+
十二、电解及其应用
1.不发光蓝发光有紫红色沉淀,不断变厚不断溶解变薄6.4V
2.(1)FeFe-2e=Fe2+
(2)C;B
(3)隔绝空气,防止Fe(OH)2被空气氧化,排尽溶液中氧气,防止生成的Fe(OH)2在溶液中被氧化
(4)B、C
(5)白色沉淀迅速变成灰绿色,最后变成红褐色
3.(1)电解池(2)铜电源的正极(3)H2SO4
4.(1)4AgNO3+2H2O
NH3·H2O+HAC
九、酸碱中和滴定
1.(1)①未搅拌②未冷却即转移③未用玻棒引流④未用胶头滴管加水定容⑤未振荡、摇匀
(2)酸式“0”以下刻度
(3)碱式滴定管,锥型瓶甲基橙黄色橙色
(4)80 %(5)A,C,E
2.(1)碱式滴定管淀粉蓝色变为无色
(2)2S2O32-+I2=S4O62-+2I-
(3)0.06
(4)AB段表示温度降到B点即90K时,超导体YBa2Cu3O7-x??电阻为零。BC段表示自90K起,随温度升高,电阻逐渐增大
十、晶体
1.C2.C3.C,D4.B
5.(1)12(2)6(3)2
6.(1)68(2)3∶1∶1CaTiO3
(3)(a+b+3c)/NAd3×1021?
7.(1)C14H20?(2)C26H32?(3)4,4,四面体
十一、原电池及其应用
1.C2.C
3.(1)①由于c(H+)的变化使平衡向不同方向移动,发生不同方向的反应,电子移动方向不同
②2I--2e-=I2
(2)AsO33-+H2O-2e-=AsO43-+2H+
十二、电解及其应用
1.不发光蓝发光有紫红色沉淀,不断变厚不断溶解变薄6.4V
2.(1)FeFe-2e=Fe2+
(2)C;B
(3)隔绝空气,防止Fe(OH)2被空气氧化,排尽溶液中氧气,防止生成的Fe(OH)2在溶液中被氧化
(4)B、C
(5)白色沉淀迅速变成灰绿色,最后变成红褐色
3.(1)电解池(2)铜电源的正极(3)H2SO4
4.(1)4AgNO3+2H2O 4Ag↓+O2↑+4HNO3
(2)石墨电极表面有气泡产生,铜电极周围溶液变蓝色,一段时间U形管有蓝色沉淀产生(3)2
十三、胶体
1.B2.甲、丁
3.(1)聚合酶,聚合反应
(2)水解酶,水解反应
(3)不会液面升高产生的渗透压和小袋内溶液渗透压之和与X溶液渗透压相等时,液面就不会再上升
Ⅱ.无机化合物
1.(1)NH4HCO3NH3H2ONO
(2)2CO2+2Na2O2=2Na2CO3+O2
(3)Fe+6HNO3(浓)
4Ag↓+O2↑+4HNO3
(2)石墨电极表面有气泡产生,铜电极周围溶液变蓝色,一段时间U形管有蓝色沉淀产生(3)2
十三、胶体
1.B2.甲、丁
3.(1)聚合酶,聚合反应
(2)水解酶,水解反应
(3)不会液面升高产生的渗透压和小袋内溶液渗透压之和与X溶液渗透压相等时,液面就不会再上升
Ⅱ.无机化合物
1.(1)NH4HCO3NH3H2ONO
(2)2CO2+2Na2O2=2Na2CO3+O2
(3)Fe+6HNO3(浓) Fe(NO3)3+3NO2↑+3H2O
2.(1)Cl2Fe(OH)3
(2)2Al+2OH-+2H2O=2AlO2-+3H2↑
(3)2HCl+NaClO=NaCl+Cl2↑+H2O
3.(1)H2(2)2ⅣA
Fe(NO3)3+3NO2↑+3H2O
2.(1)Cl2Fe(OH)3
(2)2Al+2OH-+2H2O=2AlO2-+3H2↑
(3)2HCl+NaClO=NaCl+Cl2↑+H2O
3.(1)H2(2)2ⅣA
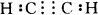
(3)C+H2O CO+H2
4.(1)加热浓硝酸会在常温下使铁表面氧化形成致密的氧化膜,阻止了反应进一步进行
(2)3NO2+H2O=2HNO3+NO
2NO+O2=2NO2
(3)白色沉淀变成灰绿色,最终变成红褐色
4Fe(OH)2+O2+2H2O=4Fe(OH)3
5.(1)Fe(OH)2Fe(OH)3NaAlO2
(2)①2Fe3O4+8Al=9Fe+4Al2O3
②Fe3O4+8HCl=FeCl2+2FeCl3+4H2O
③2Al2O3
CO+H2
4.(1)加热浓硝酸会在常温下使铁表面氧化形成致密的氧化膜,阻止了反应进一步进行
(2)3NO2+H2O=2HNO3+NO
2NO+O2=2NO2
(3)白色沉淀变成灰绿色,最终变成红褐色
4Fe(OH)2+O2+2H2O=4Fe(OH)3
5.(1)Fe(OH)2Fe(OH)3NaAlO2
(2)①2Fe3O4+8Al=9Fe+4Al2O3
②Fe3O4+8HCl=FeCl2+2FeCl3+4H2O
③2Al2O3 4Al+3O2↑
6.(1)HCl;O2
(2)2FeCl2+Cl2=2FeCl3;
Al2O3+2NaOH=2NaAlO2+H2O
(3)2∶1
7.(1)CO(2)HF
(3)C+H2O(气)
4Al+3O2↑
6.(1)HCl;O2
(2)2FeCl2+Cl2=2FeCl3;
Al2O3+2NaOH=2NaAlO2+H2O
(3)2∶1
7.(1)CO(2)HF
(3)C+H2O(气) CO+H2
(4)2F2+2H2O=4HF+O2
8.HClBa(NO3)2NaClNaAlO2NaHSO4
9.(1)①X,Z②O2③Mg+CO2
CO+H2
(4)2F2+2H2O=4HF+O2
8.HClBa(NO3)2NaClNaAlO2NaHSO4
9.(1)①X,Z②O2③Mg+CO2 2MgO+C
(2)2Fe2++4Br-+3Cl2=6Cl-+2Fe3++2Br2
10.(1)CO
2MgO+C
(2)2Fe2++4Br-+3Cl2=6Cl-+2Fe3++2Br2
10.(1)CO
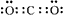
2Mg+CO2 2MgO+C
(2)①FeBr3②2Fe2++Br2=2Fe3++2Br-
(3)2Fe3++Fe=3Fe2+
(4)2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
11.(1)(NH4)2SO3(NH4)2SO4SO2NH3K2SO3K2SO4
(2)SO32-+Br2+H2O=SO42-+2Br-+2H+
(3)用焰色反应验证K+的存在,透过蓝色钴玻璃,焰色为浅紫色;先加盐酸,再将产生的气体通过品红溶液,若品红溶液退色,则说明有SO32-或HSO3-,另取少量溶液直接加BaCl2,若有白色沉淀生成,即确定含有SO32-
12.(1)ZnZn+2Fe3+=2Fe2++Zn2+
Zn+Cu2+=Zn2++Cu
Zn+Fe2+=2Fe+Zn2+
(2)H2O2加入氧化剂,把Fe2+氧化到Fe3+,以便于后面除去,而且加入H2O2不会引入新的杂质
(3)用NaOH溶液或ZnO调整pH使Fe完全沉淀而Zn不沉淀。
13.(1)ClO2具有强氧化性,是高效消毒剂,且不会跟有机物发生取代和加成反应,是较为理想的饮用水消毒剂
(2)2NaClO3+4HCl=Cl2↑+2ClO2↑+2NaCl+2H2O
(3)2NaClO2+Cl2=2ClO2↑+2NaCl,此法优点是ClO2的产率高、质量好,无Cl2杂质。
(4)2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O
14.(1)3H2S+2Fe(OH)3=Fe2S3+6H2O
(2)2.7n?(3)B
(4)生成纯碱(或作制冷剂等)
(5)
2MgO+C
(2)①FeBr3②2Fe2++Br2=2Fe3++2Br-
(3)2Fe3++Fe=3Fe2+
(4)2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
11.(1)(NH4)2SO3(NH4)2SO4SO2NH3K2SO3K2SO4
(2)SO32-+Br2+H2O=SO42-+2Br-+2H+
(3)用焰色反应验证K+的存在,透过蓝色钴玻璃,焰色为浅紫色;先加盐酸,再将产生的气体通过品红溶液,若品红溶液退色,则说明有SO32-或HSO3-,另取少量溶液直接加BaCl2,若有白色沉淀生成,即确定含有SO32-
12.(1)ZnZn+2Fe3+=2Fe2++Zn2+
Zn+Cu2+=Zn2++Cu
Zn+Fe2+=2Fe+Zn2+
(2)H2O2加入氧化剂,把Fe2+氧化到Fe3+,以便于后面除去,而且加入H2O2不会引入新的杂质
(3)用NaOH溶液或ZnO调整pH使Fe完全沉淀而Zn不沉淀。
13.(1)ClO2具有强氧化性,是高效消毒剂,且不会跟有机物发生取代和加成反应,是较为理想的饮用水消毒剂
(2)2NaClO3+4HCl=Cl2↑+2ClO2↑+2NaCl+2H2O
(3)2NaClO2+Cl2=2ClO2↑+2NaCl,此法优点是ClO2的产率高、质量好,无Cl2杂质。
(4)2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O
14.(1)3H2S+2Fe(OH)3=Fe2S3+6H2O
(2)2.7n?(3)B
(4)生成纯碱(或作制冷剂等)
(5)

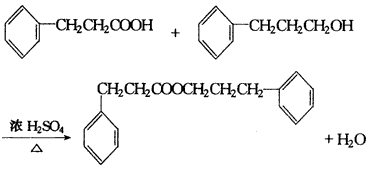
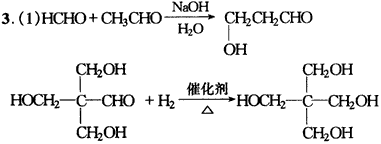
Ⅲ.有机化学 一、有机物性质及反应类型 1.C??2.D 3.(1)BCK (2)取代取代加成
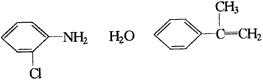
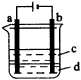
2.(1)由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。若用图26所示实验装置则可制得纯净的Fe(OH)2沉淀。两极材料分别为石墨和铁。
 |
|
图26 电解装置 |
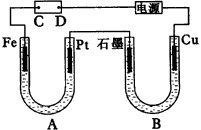
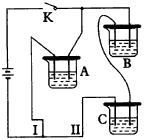
a极材料为___________。 其电极反应式为___________。 (2)电解液d可以是___________,则白色沉淀在电极上生成;也可以是___________,则白色沉淀在两极之间生成。 A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液 (3)液体c为苯,其作用是_________,在加入苯之前,对d溶液进行加热处理的目的是________。 (4)为了在短时间内看到白色沉淀,可以采取的措施是___________。 A.改用稀H2SO4做电解液 B.适当增大电源电压 C.适当缩小两电极间距离 D.适当降低电解液温度 (5)若d改为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接电源,继续电解,除了电极上看到气体,另一明显现象为___________。 3.某学生设计了如图27的装置(框内部分未画出),在装置内起初发生的反应为: Cu+H2SO4-→H2↑+CuSO4
 |
|
图27 实验装置 |
试回答: (1)该装置的名称是___________; (2)A,B中至少有一种金属___________,接___________; (3)C溶液中含有___________。 4.某电解装置如图28所示,(B)装置内盛1L2mol·L-1Na2SO4溶液,(A)装置中盛1L2mol·L-1AgNO3溶液。通电后,润湿的淀粉KI试纸的C端变蓝色。电解一段时间后,试回答:
 |
|
图28 实验装置 |
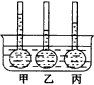
(1)A中发生反应的化学方程式为___________。 (2)在B中观察到的现象是___________。 (3)室温下,若从电解开始到时间为t时,A、B装置中共收集到0.168L(标准状况)气体。若电解过程中无其他副反应发生,且溶液体积变化忽略不计。则在t时,A溶液的pH为___________。 十三、胶体 1.下列关于Fe(OH)3胶体的说法不正确的是( )。 A.Fe(OH)3溶胶与硅酸溶胶混合,将产生凝聚现象 B.Fe(OH)3胶体粒子在电场作用下将向阳极运动 C.Fe(OH)3胶粒不停地作布朗运动 D.光线通过Fe(OH)3溶胶时会产生丁达尔现象 2.有甲、乙、丙、丁和Ag2S五种溶胶,按甲和乙、丙和丁、乙和丁、甲和Ag2S胶体两两混合均出现沉淀,则上述溶胶中胶粒带正电的是___________(已知Ag2S胶体胶粒带负电荷)。 3.如29图所示,有甲、乙、丙三个由半透膜做成的小袋,上连一根玻璃管,袋内均装有物质X,置于37℃的恒温Y溶液中,玻璃管内液面既不上升也不下降,分别在甲乙小袋内加入物质A和B,丙小袋内不加。假定加入A、B后基本不影响溶液的浓度,丙玻璃管的液面既不上升也不下降,甲乙两管中的液面变化趋势如图29,试回答下列问题:
 |
|
图29 实验装置 |
(1)甲管内加的A是一种___________,其中进行的反应是___________。 (2)乙管内所加的B是一种___________,其中发生的反应是___________。 (3)甲管内液面是否无限上升?为什么?
 |
|
图30物质间的转化关系 |
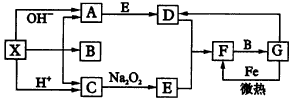
根据图中关系: (1)推断化学式:X__________,A__________,B__________,D__________; (2)写出C→E反应的化学方程式__________; (3)写出G→F反应的化学方程式__________。 2.图31中A-L分别表示反应中一种常见物质,E、F、I在通常状况下是气体单质,其中E为有刺激性气味的气体,X、Y是常见的金属单质,H为白色沉淀,J为红褐色沉淀,参加反应的水以及生成的水在图中已略去。
 |
|
图31物质间的转化关系 |
填写下列空白: (1)E是(填化学式、下同)__________,J是__________。 (2)写出D+X-→F+C的离子方程式?__________。? (3)写出A+B-→C+E的化学方程式?__________。? 3.气体A只含X、Y两种短周期元素,X的原子序数大于Y的原子序数。B、D、E是中学化学中的常见气体。各物质有如图32所示的转化关系。
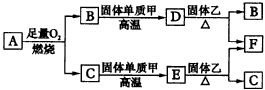 |
|
图32物质间的转化关系 |
试回答下列问题: (1)若气体A中,X与Y的质量比小于3,则气体A中肯定有(写化学式)__________。 (2)若气体A的分子为线型结构,且X与Y元素的质量比数值上等于X的相对原子质量,则X元素位于周期表中__________周期__________族,A的电子式为__________。 (3)C与固体甲在高温下反应的化学方程式为__________。 4.A、B是中学化学里常用的物质,其中B是单质,A是化合物;它们之间相互反应以及生成物之间的转化关系如图33所示。
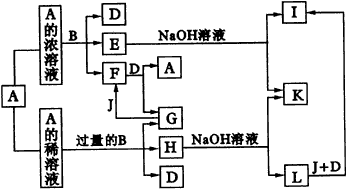 |
|
图33物质间的转化关系 |
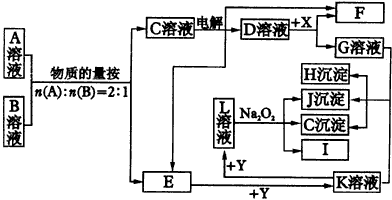
已知E溶液与石炭酸的稀溶液混合时,溶液呈紫色。请回答: (1)B和A的浓溶液反应的条件是__________,而常温下难反应的原因是__________。 (2)写出F和G相互转化的化学方程式: F→G__________;G→F__________。 (3)L转化成I的现象是__________;有关的化学方程式__________。 5.A-I分别表示中学化学中常见的一种物质,它们之间相互转化关系如图34所示(部分反应物、生成物没有列出):
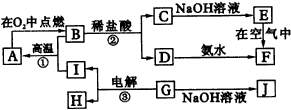 |
|
图34物质间的转化关系 |
已知:A、B、C、D、E、F六种物质中均含有同一种元素;G为主族元素的固态氧化物。 (1)写出物质的化学式 E__________,F__________,J__________。 (2)写出反应的化学方程式 ①__________;②__________;③__________。 6.图35转化关系中各物质均是中学化学中常见的物质,A是含有结晶水的盐,G、K为固体单质,H为无色气体单质,C为红棕色粉末,可用作油漆的颜料,B常用作耐火材料。
 |
|
图35物质间的转化关系 |
请回答下列问题: (1)写出下列物质的化学式:D__________,H__________。? (2)写出反应的化学方程式:M→F__________;B与NaOH溶液反应__________。 (3)若由A生成的C与由B生成的G恰好完全反应,则A与B的物质的量之比为__________ 7.如图36,已知:
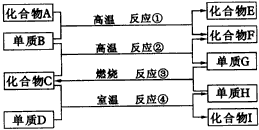 |
|
图36物质间的转化关系 |
(1)化合物E与水反应生成白色浆状物; (2)化合物F是不能生成盐的氧化物; (3)单质D能与某些稀有气体反应; 据此,请填空: (1)化合物F是__________。 (2)化合物I是__________。 (3)反应②的化学方程式是__________。 (4)反应④的化学方程式是__________。 8.A、B、C、D分别是NaCl、Ba(NO3)2、NaAlO2和HCl四种溶液中的一种,现利用一种盐溶液X,用图37所示的方法,即可将它们一一确定(X仅由短周期元素组成)。
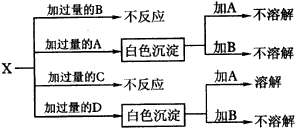 |
|
图37物质间的转化关系 |
试确定A、B、C、D、X各代表什么溶液。 A.__________,B.__________,C.__________,D.__________,?X.__________。? 9.如图38所示,甲、乙、丙是三种常见单质,X、Y、Z是三种常见化合物。
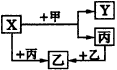 |
|
图38 物质间的转化关系 |
(1)若甲是具有还原性单质,X、Y、Z中只有一种是离子晶体,则: ①X、Y、Z中含丙元素的是__________; ②乙的化学式是__________; ③X与甲反应的化学方程式是__________。 (2)若甲是具有氧化性的单质,丙在通常情况下呈液态,Y和Z具有相同的阳离子,则X与足量的甲在溶液中完全反应的离子方程式__________。 10.A、B、C是中学化学中常见的无机物,且各由两种元素组成,甲、乙、丙是三种常见的单质,这些化合物和单质之间存在如图39所示转化关系(这些转化都不需要使用催化剂)。
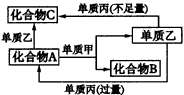 |
|
图39物质间的转化关系 |
试回答以下问题: (1)若甲作还原剂,甲是常见金属单质,乙是常见非金属单质,则C的化学式是__________,A的电子式是__________,A与甲反应的化学方程式为__________。 (2)若甲作氧化剂,甲是常见的非金属单质,丙是常见金属,且反应都是在溶液中通常条件下进行,则:①C的化学式是__________,②化合物A与单质乙反应的离子方程式是__________。 (3)化合物C与单质丙反应的离子方程式是__________。 (4)当化合物A与单质甲的物质的量之比为2∶3时,A与甲恰好完全反应且符合上图所示的转化关系,则反应的离子方程式是__________。 11.从某物质A的水溶液出发有图40所示的一系列变化。回答问题:
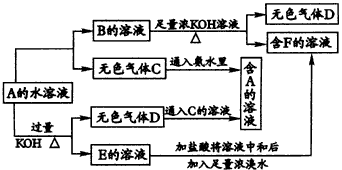 |
|
图40物质间的转化关系 |
(1)写出各物质的化学式: A__________,B__________,C__________, D__________,E__________,F__________。 (2)写出E→F的离子方程式__________。 (3)鉴定物质E的方法是__________。 12.某化工厂生产皓矾(ZnSO4·7H2O),结晶前的酸性溶液中含有少量的Cu2+、Fe2+、Fe3+等杂质离子。为了除去杂质离子,获得纯净的皓矾晶体,该工厂设计了如图41的可行工艺流程:
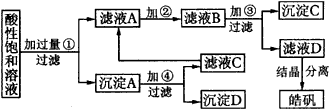 |
|
图40工艺流程 |
已知,开始生成氢氧化物沉淀到沉淀完全的pH范围分别是Fe(OH)3:2.7-3.7;Fe(OH)2:7.6-9.6;Zn(OH)2:5.7-8,试回答以下问题: (1)加入的试剂①应是__________;主要的离子反应方程式有__________。 (2)加入的试剂②,供选择的试剂有:氯水、NaClO溶液、20%H2O2溶液、浓H2SO4、浓HNO3;应选用__________,其理由是__________。 (3)加入试剂③的名称和目的是__________。 13.用氯气对饮用水消毒已有百年历史。这种消毒方法会使饮用水中的有机物发生氯代,生成有机含氯化合物,对人体有害,世界环保联盟即将全面禁止用氯气对饮用水消毒,建议推广采用广谱性高效消毒剂二氧化氯(ClO2)。 (1)使用ClO2作饮用水消毒剂的优点是__________。 (2)目前欧洲一些国家用NaClO3氧化浓盐酸来制取ClO2,同时有Cl2生成,且Cl2体积为ClO2的一半。表示这一反应的化学方程式是__________。 (3)我国最近研究成功用氯气氧化亚氯酸钠(NaClO2)(在氮气保护下)制得ClO2,表示这一反应的化学方程式是__________,这一方法的优点是__________。 (4)在H2SO4酸性条件下,用Na2SO3还原NaClO3也可制得ClO2,表示这一反应的化学方程式是__________。 14?利用天然气合成氨的工艺流程示意如图42。
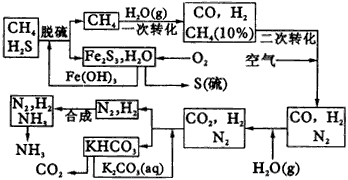 |
|
图42工艺流程示意图 |
依据下述流程,完成下列填空: (1)天然气脱硫时的化学方程式是__________。 (2)nmolCH4经一次转化后产生CO0.9nmol,产生H2__________mol(用含n的代数式表示)。 (3)K2CO3(ag)和CO2反应在加压下进行,加压的理论依据是__________。 A.相似相溶原理 B.勒夏特列原理 C.酸碱中和原理 (4)由KHCO3分解得到的CO2可以用于__________(写出CO2的一种重要用途)。 (5)整个流程有三处循环,一是Fe(OH)3循环,二是K2CO3(ag)循环,请在上述流程图中标出第三处循环(循环方向、循环物质)。
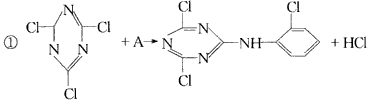
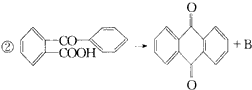
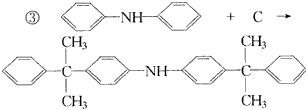
反应①的类型是____________,反应②类型是____________,反应③类型是____________。 A的结构简式是____________,B的结构简式是____________,C的结构简式是____________。 二、有机反应 1.某有机物A在不同条件下反应,分别生成B1+C1和B2+C2,C1又能分别转化为B1或C2,C2能进一步氧化,反应如图43所示,其中只有B1既能使溴水退色又能和Na2CO3反应放出CO2。回答并填空:
 |
|
图43物质间的转化关系 |
(1)B2、C1分别属于下列哪一类化合物? ①溴代饱和一元醇②溴代不饱和一元醇③饱和一元醇④不饱和一元醇⑤溴代饱和羧酸盐⑥溴代不饱和羧酸盐⑦饱和羧酸盐⑧不饱和羧酸盐 B2属于____________,C1属于____________(填编号) (2)反应类型X属于____________反应,Y属于____________反应,Z属于____________反应。 (3)有机化合物的结构简式:A____________,B1____________,C2____________。 2.已知:(1)醛在一定条件下可以两分子加成:

产物不稳定,受热即脱水而生成不饱和醛。 (2)卤代烃在氢氧化钠醇溶液中加热可生成不饱和化合物:
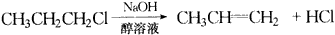
物质B是一种可以作为药物的芳香族化合物,请根据图44(所有无机产物均已略去)中各有机物的转变关系回答问题。
 |
|
图44物质间的转化关系 |
(1)写出B、F的结构简式B____________,F____________。 (2)图示中涉及的有机反应类型有下列的____________(填序号)。 ①取代反应②加成反应③氧化反应④还原反应⑤消去反应⑥聚合反应⑦酯化反应⑧水解反应 (3)写出G、D反应生成H的化学方程式____________。 (4)F若与H2发生加成反应,每摩F最多消耗的H2的物质的量为________mol。 3.季戊四醇硝酸酯c(C(CH2ONO2)4)为长效抗心血管痛药物,作用比硝酸甘油弱,生效缓慢而持久。 已知两个醛分子在稀碱溶液中可以发生加成反应,其特点是一个醛分子中的活泼氢(即与醛基相邻碳原子上的氢原子,也叫α氢原子)加到另一醛分子中醛基的氧原子上,其余部分则加到该醛基的碳原子上。 如

现以乙烯为初始原料,按图45指定步骤制备季戊四醇硝酸酯。参加下列反应的A物质在常温下是一种无色、有强烈刺激性气味的气体,易溶于水,其水溶液具有杀菌和防腐能力,可用来浸制生物标本。 请按要求回答下列问题:
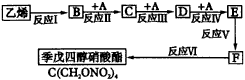 |
|
图45物质间的转化关系 |
(1)写出下列反应方程式(注明反应条件并配平): B+A→C____________,E→F____________。 (2)写出反应类型 反应Ⅰ____________;反应Ⅱ____________; 反应Ⅴ____________;反应Ⅵ____________。 4.有三种只含C、H、O的有机化合物A1、A2、A3,它们互为同分异构体。室温下A1为气态,A2、A3是液态。分子中C与H的质量分数之和是73.3%,在催化剂(Cu、Ag等)存在下,A1不起反应,A2、A3分别氧化得到B2、B3。B2可以被硝酸银的氨水溶液氧化得到C2,而B3则不能。 上述关系也可以表示如图46:
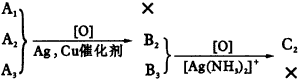 |
|
图46?转换关系图 |
请用计算、推理,填写以下空白。 (1)A2的结构简式____________。 (2)B3的结构简式____________。 (3)A3和C2反应的产物是____________。 5.醇和酸在催化剂作用下可直接反应生成酯,而酚不能;但是酚跟有机酸酐作用能生成酯。例如:
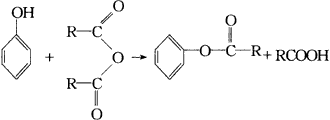
|
(R代表烃基或H原子)现以 |
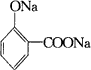 |
为基本原料, |
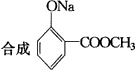
请选择必要的其他反应物,用最佳途径合成下列有机物,写出反应的化学方程式:
|
(1) |
 |
(2)  |
(1)①____________,②____________,③____________。
(2)①____________,②____________。
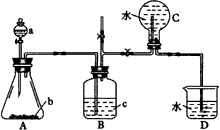 |
|
图47实验装置 |
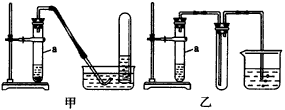 |
|
图48实验装置 |
回答下列问题: (1)气体X的分子式是___________。 (2)所选药品a是___________,b是___________,c是___________。? (3)图48装置的甲和乙,能代替图47装置的简易装置是___________(填“甲”或“乙”)。 (4)请写出在试管a中所发生反应的化学方程式___________。 (5)从反应开始到反应结束,预期在试管a中可观察到的实验现象有哪些?请依次逐步写出___________。 2.红热的铁能与水蒸气反应,有氢气生成,现用图49所示的装置进行铁在高温下与水蒸气反应的实验,并用简单的方法收集、检验生成的氢气。请回答下列问题:
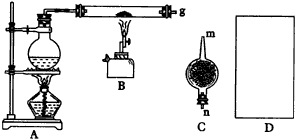 |
|
图49实验装置 |
(1)写出铁在高温下与水蒸气反应的化学方程式___________。 (2)干燥管C内盛放的药品是___________或___________(填化学式)。干燥管的___________(m或n)端与g导管相接。 (3)在D处画出用试管来收集氢气的简单方法装置图(所需其他仪器自己选择)。 (4)怎样用简单方法检验收集到的气体是氢气,简述实验操作步骤和现象___________。 3.如图50是制取氯气并以氯气为原料进行待定反应的装置,请回答下列问题。
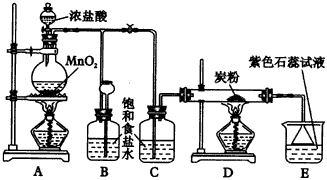 |
|
图50实验装置 |
(1)A是氯气发生装置,其中发生反应的离子方程式为___________。 (2)实验开始时,先点燃A处的酒精灯,打开弹簧夹,让Cl2充满整个装置,再点燃D处的酒精灯,Cl2通过C瓶后再进入D(D装置的硬质玻璃管内盛有炭粉)发生氧化还原反应,其产物为CO2和HCl。D中发生反应的化学方程式为___________,装置C的作用是___________。 (3)在实验过程中,E处发生的现象为?___________。? (4)D处反应完毕后关上弹簧夹,移去酒精灯,由于余热的作用,A处仍有Cl2产生,此时B中出现的现象是___________,装置B的作用是?___________。? (5)若实验中使12mol·L-1的浓盐酸10mL与足量的MnO2反应,则生成的Cl2的物质的量总是小于0.03mol,其原因是___________。 (6)若要吸收从硬质玻璃管中导出的气体,E中应盛放___________溶液,其中有毒气体与之反应的离子方程式是___________。 4.下列试剂和图51的仪器可用来制备氯气、溴单质、氧气和溴乙烷等。 试剂有:二氧化锰、氯酸钾、氯化钾、溴化钾、双氧水、浓硫酸、乙醇、NaOH、水等。仪器见图51。请填空:
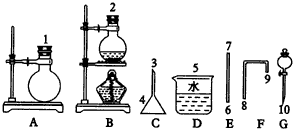 |
|
图51实验装置 |
(1)利用___________仪器可作为制溴单质的装置(填仪器代号,下同),制取反应方程式为___________。 (2)组装制O2的发生装置选用的仪器是___________,化学方程式为___________。 (3)已知溴乙烷是一种难溶于水的无色液体,密度约为水的1.5倍,沸点为38.4℃;乙醇沸点为78.5℃;HBr的沸点为-67℃,Br2的沸点为58.8℃,密度为3.12g·cm-3。 ①收集溴乙烷,选C和D,而不选E和F的理由是___________,橡皮塞2接8端而不接9端的理由是___________。 ②反应物中要加入适量水,除溶解KBr固体外,其作用还有___________。 ③从棕黄色的粗溴乙烷中制取无色的溴乙烷,应加入的试剂是___________,必须使用的主要仪器是___________(填名称)。 5.为测定已变质的过氧化钠的纯度,设计如图52所示的实验;Q为一具有良好的弹性气球,称取一定量的样品放于其中,按图安装的实验装置打开分液漏斗的活塞,将稀H2SO4滴入气球中。请填空:
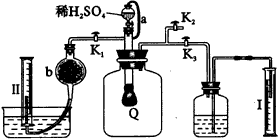 |
|
图52实验装置 |
(1)Q内发生反应生成___________种气体,其中的反应有___________个氧化还原反应。 (2)为测定反应生成气体的总体积,滴稀H2SO4前必须关闭(填K1、K2或K3,下同)___________,打开___________。 (3)当上述反应停止,将K1、K2、K3处于关闭状态,然后先打开K2,再缓缓打开K1,这时可观察到的现象是___________。 (4)导管a的作用是___________。 (5)b中装的固体试剂是___________,为何要缓缓打开K1___________。 (6)实验结束时量筒Ⅰ中有xmL水,量筒Ⅱ中收集到ymL气体,则过氧化钠的纯度是___________(体积折算到标准状况)。
3.根据可逆反应:AsO43-+2I-+2H+ AsO33-+I2+H2O,设计如图24的实验装置。B烧杯中装有Na2AsO4和Na3AsO3溶液,A烧杯中装有I2和KI溶液。两烧杯中用一倒置的装有饱和KI溶液的U形管相连,该装置称为盐桥,其作用是避免两烧杯中的溶液相混合,又能使两烧杯中的溶液因连通而导电。C1、C2棒为惰性电极。进行如下操作:
AsO33-+I2+H2O,设计如图24的实验装置。B烧杯中装有Na2AsO4和Na3AsO3溶液,A烧杯中装有I2和KI溶液。两烧杯中用一倒置的装有饱和KI溶液的U形管相连,该装置称为盐桥,其作用是避免两烧杯中的溶液相混合,又能使两烧杯中的溶液因连通而导电。C1、C2棒为惰性电极。进行如下操作:
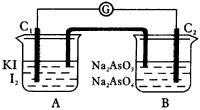 |
|
图24 实验装置 |
(1)向A溶液中逐滴加入浓HCl,发现电流计指针发生偏转。 (2)若改向B溶液中滴加40%NaOH溶液,发现电流计指针向相反方向偏转, 试回答下列问题: ①两次操作中,电流计的指针偏转方向相反,为什么?试用化学平衡原理解释之___________。不同方向的反应,由于转移方向不同,②(1)操作过程中,C1棒上发生的反应是___________。 (2)操作过程中C2上发生的反应是___________。 十二、电解及其应用 1.如图25所示,在水泥槽中放入蒸馏水,在蒸馏水中放入一块纯铜板和一块粗铜板作电极,用导线连接电源、开关和一个阻值4欧的灯泡。合上开关,小灯泡将___________,然后断开开关,再加入适量的无水硫酸铜,待全部溶解后,溶液将呈___________色,这时合上开关,小灯泡将___________,纯铜板上发生的现象是___________,粗铜板上发生的现象是___________。若测得此过程,1s内共有3×1018个Cu2+和2×1018个SO42-通过两极板间某一截面,则加在灯泡两端的电压为___________。
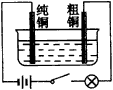 |
|
图25 电解装置 |
6.图21为高温超导领域里的一种化合物--钙钛矿晶体结构,该结构是具有代表性的最小重复单位。 (1)在该物质的晶体结构中,每个钛离子周围与它最接近且距离相等的钛离子、钙离子各有___________、___________个。 (2)该晶体结构中,元素氧、钛、钙的离子个数比是___________。 该物质的化学式可表示为___________。 (3)若钙、钛、氧三元素的相对质量分别为a,b,c,晶体结构图中正方体边长(钛原子之间的距离)为dnm(1nm=10-9m),则该晶体的密度为___________g·cm-3。 7.1932年捷克的Landa等人从南摩拉维亚油田的石油分馏物中发现一种烷(代号A),次年用X-射线技术证实了其结构,竟是一个叫Lukess的人早就预言过的。后来A被大量合成,并发现它们胺类衍生物具有抗病毒、抗震颤的药物活性而开发为常用药。图22给出三种已经合成的2,3,4个A为基本结构单元模块,像搭积木一样“搭”成的较复杂笼状烷。 根据上述条件推断并填空:
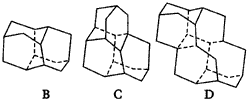 |
|
图22 基本结构单元模块 |
(1)B的分子式为___________。 (2)若在D上继续增加一“块”A“模块”,得到E,则E的分子式为___________。 (3)A中含有的六元环数为___________个,其中有___________个碳原子为三环所共有,这几个碳原子所围成的空间几何形状为___________。 十一、原电池及其应用 1.日常所用的干电池的电极分别为碳棒和锌皮,以糊状NH4Cl,ZnCl2作电解液(其中加入MnO2氧化吸收H2),电极反应可简化为: Zn-2e=Zn2+? 2NH4++2e-→2NH3+H2(NH3可用于结合Zn2+),根据上述判断下列说法正确的是( )。 A.干电池中锌为正极,碳为负极 B.干电池工作时,电子由碳极经外电路流向锌极 C.干电池长时间连续工作时,内装糊状物可能流出腐蚀电池 D.该干电池可以实现化学能向电能的转化和电能向化学能的转化 2.某同学为完成2HCl+2Ag=2AgCl↓+H2↑反应,设计了下列四个实验,如图23,你认为可行的方案是( )。
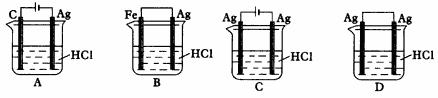 |
|
图23 四种实验装置 |
 |
|
图15 不同温度下的电阻值 |
现取4.00×10-2gYBa2Cu3O7-x样品,用稀盐酸溶解,在氩气保护下加入1.00gKI固体充分反应,Cu2+、Cu3+均转化为CuI,用0.0100mol·L-1Na2S2O3溶液滴定反应中生成的I2,在滴定终点时消耗0.0100mol·L-1的Na2S2O3溶液18.14mL。填空并回答: (1)盛装Na2S2O3溶液进行滴定的仪器是__________,该实验选用的指示剂为__________,到达终点的现象是__________。 (2)写出滴定过程中S2O32-转变为S4O62-的离子方程式。 (3)求出所用YBa2Cu3O7-x样品中x的值。 (4)根据题给YBa2Cu3O7-x的电阻与温度关系的R-T图示说明曲线中AB、BC段的物理意义。
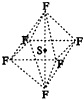
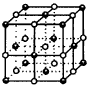 |
 |
|
图16 NaCl晶胞 |
图17 SF6分子结构 |
2.SF6是一种无色气体,具有很强的稳定性,可用于灭火。SF6的分子结构如图17所示,呈正八面体型。如果F元素有两种稳定的同位素,则SF6的不同分子种数为( )。 A.6种 B.7种 C.10种 D.12种 3.图18所示某硅氧离子的空间结构示意图(虚线不表示共价键)。通过观察分析,下列叙述正确的是( )。
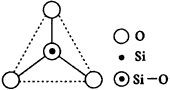 |
|
图18 硅氧离子结构 |
A.键角为120° B.化学组成为SiO32-? C.键角为109°28′ D.化学组成为SiO42- 4.2001年报道硼和镁形成的化合物刷新了金属化合物超导温度的最高记录。图19示意的是该化合物的晶体结构:镁原子间形成正六棱柱,且棱柱的上下底面还各有一个镁原子;6个硼原子位于棱柱侧面上。则该化合物的化学式可表示为( )。
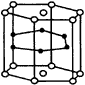 |
|
图19 硼镁化合物结构 |
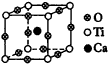
A.MgB B.Mg3B2 C.Mg2B D.Mg2B2 5.二氧化硅晶体是立体的网状结构。其晶体模型如图20。认真观察晶体模型并回答下列问题: (1)二氧化硅晶体中最小环为___________元环。 (2)每个硅原子为___________个最小环共有。 (3)每个最小环平均拥有___________个氧原子。
 |
 |
|
图20 二氧化硅晶体 |
图21 钙钛矿晶胞 |
 |
|
图14?电解装置 |
(1)指出A、B、C是(或可能是)什么溶液(写溶质式)__________。 (2)A、B、C三溶液的电阻的大小关系为?__________,?由此可见电解质溶液中的电阻大小应与__________有关。 (3)若向C溶液中滴入酚酞呈红色,则C是__________,将A、B、C分别以等体积两两混合,结果哪种组合的混合液中水的电离度最大?(用AB、BC、AC等字母回答)__________。用离子方程式解释其原因__________。
23.(11分)有机物A的结构简式是 ,它可以通过不同的反应得到
下列物质:
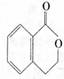

A. B.
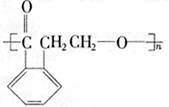
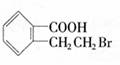
C. D.
(1)A分子中含氧官能团的名称是 。
(2)写出制取B的化学反应方程式 。
(3)写出由A制取C、D、E三种物质的有机反应类型:C ;
D ;E 。
(4)写出两种既可看作酯类又可看作酚类,且分子中苯环上连有三种取代基的A的同分异构体的结构简式(要求这两种同分异构体分子中苯环上的取代基至少有一种不相同):
; 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com