
题目列表(包括答案和解析)
 1、定义:电解质电离产生的阳离子全部是H+的化合物。
1、定义:电解质电离产生的阳离子全部是H+的化合物。





 对该定义要全面分析理解,象H2O、 OH 电离出的阳离子亦都是H+,中学里不能称为酸的。
含氧酸(H2SO4、HNO3等)
对该定义要全面分析理解,象H2O、 OH 电离出的阳离子亦都是H+,中学里不能称为酸的。
含氧酸(H2SO4、HNO3等)
2、分类 (1)酸中组成元素
无氧酸(HCl、H2S等)
 一元酸
一元酸
(2)酸分子完全电离产生H+数 二元酸
多元酸
注意:能否根据酸分子中H原子数确定酸是几元酸?例如:H2C2O4、H2CO2、H4C2O2它们分别是几元酸?
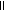 O
O
 对于含氧酸,应根据酸分子中--OH数目确定,H2C2O4(C-OH)二元酸、H2CO2
对于含氧酸,应根据酸分子中--OH数目确定,H2C2O4(C-OH)二元酸、H2CO2
 C-OH
C-OH

 O
O
O
O
O
O
(H-C-OH)为一元酸H4C2O2(CH3-C-OH)为一元酸。对常见的酸要会判断:
O
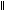 ↑
O
↑
O
 HNO3(HO-NO2),H2SO4(HO-S-OH),H3PO4(HO-P-OH);不熟悉的根据信
HNO3(HO-NO2),H2SO4(HO-S-OH),H3PO4(HO-P-OH);不熟悉的根据信
↓ OH
O
息去判断。
例如:H3PO3(亚磷酸)与NaOH反应,只能形成二种钠盐,NaH2PO3和Na2HPO3,请问H3PO3为几元酸?(二元酸)
 强酸
强酸
(3)根据酸是否完全电离
弱酸
判断方法:①同种元素形成多种含氧酸,化合价高的酸性强,如HClO、HClO2、HClO3、HClO4;H2SO4和H2SO3等。
②运用元素周期律知识。
③利用盐和酸反应原理(强酸制弱酸)
4、电离度(α)--明确只有弱电解质才讲电离度。



 思考:CH3COOH
CH3COO-+H+-Q 改变下列条件中的一个,平衡向哪个方向移动?电离度如何变化?[H+]如何改变?
思考:CH3COOH
CH3COO-+H+-Q 改变下列条件中的一个,平衡向哪个方向移动?电离度如何变化?[H+]如何改变?
①增大CH3COOH浓度 ②升温 ③加水稀释
(①→,α减小,[H+]增大; ②→,α增大,[H+]增大;③→,α增大,[H+] 减小)
3、电解质的电离--物理变化,注意与电解概念的区别和联系。
电解一定发生的是化学变化,电离不需通电。电解是建立在电离的基础上。
2、电解质能导电的原因--存在自由移动的离子。
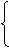 溶于水--水分子作用,破坏其化学键
溶于水--水分子作用,破坏其化学键
电解质
 自由移动离子
自由移动离子 过程称
过程称
熔融--热能作用、破坏离子键
1、定义:在水溶液中或熔化状态下能导电的化合物--电解质
在水溶液和熔化状态下都不能导电的化合物--非电解质
对这二个概念的理解上,首先要明确不管是电解质还是非电解质均为化合物,而不是混合物(除氨水、盐酸为特例属于电解质),特别要注意混合物不能称电解质,也不能根据物质的导电性来判断,根据定义,显然,化合物不是电解质即为非电解质。
 强电解质--水溶液中不存在电离平衡的电解质
强电解质--水溶液中不存在电离平衡的电解质
 电解质
电解质
弱电解质--水溶液中存在电离平衡的电解质
化合物
非电解质
例1:下列物质哪能些属于电解质?哪些属于非电解质
①液态氯化氢 ②浓H2SO4 ③AgCl ④熔化的KNO3 ⑤酒精溶液
⑥液态蔗糖 ⑦乙醛 ⑧乙酸 ⑨SO2 ⑩Cu
(电解质①③④⑧,非电解质⑥⑦⑨)
例2:下列说法正确的是
A、稀硫酸能导电,稀硫酸为电解质。
B、能导电的化合物一定是电解质。
C、Na2CO3固体不导电,是因为没有离子存在。
D、CaCO3不溶于水,因此为非电解质。
(正确答案B)
常见强电解质:绝大多数盐类、强酸、强碱[ⅠA、ⅡA(除Be、Mg)],部分氧化物(Na2O、Al2O3)
弱电解质:弱酸、弱碱(一般指不溶性),个别有机物以及极弱电解质水。
判断强弱电解质除运用上述知识外,还可通过以下方法来判断:
① 运用元素周期律知识。
② 根据酸、碱物质的量浓度与之对应的PH值来判断。
③ 根据盐溶液的PH值来判断。
例:已知0.1mol/L的甲酸PH值不等于1,说明甲酸是强电解质还是弱电解质?
已知甲酸钠溶液PH值大于7,说明甲酸是强酸还是弱酸?
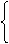 利用强酸制弱酸原理
利用强酸制弱酸原理
④ 根据化学反应来判断
利用复分解反应原理
例:硫酸铅既不溶于水,也不溶于酸,但能溶于CH3COONH4.
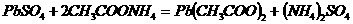 请写出H2S与Pb(CH3COO)2
请写出H2S与Pb(CH3COO)2
反应的离子方程式。
解析:本题隐含一条重要信息:PbSO4和CH3COONH4反应的基本类型为复分解反应。复分解反应发生的条件是有气体或沉淀或水(实质形成弱电解质),显然(NH4)2SO4为强电解质,只有Pb(Ac)2为难电离物质,因此,H2S和Pb(Ac)2反应的离子方程式即为它们反应的化学方程式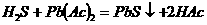 。
。
12.

11.(1)D (2)加入的液溴颜色基本不褪
(3)除去过量的溴)(4)四溴化萘、铁粉(5)1.3
10.(1)将导管的出口浸人水槽的水中,手握住试管,溴气泡从导管口逸出,放开手后有少量水进人导管,表明装置不漏气。
(2) ②①③
(3) 慢慢将量筒下移。
(4) 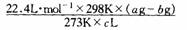
9.(1)不能,2NH3+H2SO4═(NH4)2SO4,NH3被吸收,无法进人硬质试管参加反应。
(2)在NH3进人反应器前,先通过饱和氨水,观察气泡逸出速率,使NH3的逸出速率与O2在浓H2SO4中的逸出速率>4:5,以保证NH3过量,然后使NH3通过盛有碱石灰的干燥管后,再进入反应器进行催化氧化。
在集气瓶上应连接带导管的双孔塞,将多余气体导人盛溴FeSO4溶液的烧杯中来吸收尾气,防止NO污染空气,同时阻止空气进人集气瓶,氧化生成NO。
(3)在实验开始前应先通人NH3,排净装置中的空气,防止生成的NO被氧化,在反应过程中就出现颜色变化。
8.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com