
题目列表(包括答案和解析)
1、 溶质溶解:溶质分子或离子扩散过程→物理过程--吸热
溶质溶解:溶质分子或离子扩散过程→物理过程--吸热
溶质分子或离子水合过程→化学过程--放热
溶质溶解于水温度升高、降低还是基本不变取决于扩散过程吸收的热量与水合过程放出的热量大小.浓H2SO4、NaOH固体溶于水放出大量的热,NH4NO3溶于水吸收大量的热,NaCl等溶于水温度基本不变.
3、 胶体分类:气溶胶(云、烟、雾)
胶体分类:气溶胶(云、烟、雾)
液溶胶(Fe(OH)3等)
固溶胶(有色玻璃,烟水晶)
2、胶体性质:
⑴布朗运动--是否只有胶体才具有该性质?(不是)
⑵丁达尔现象--胶体独有的性质,因此用于鉴别胶体与其它分散系最简单的方法.
⑶电泳现象--可鉴别胶体与其它分散系,主要用于证明胶粒带电且带有何种电荷,反之,若已知胶粒带何种电荷[如Fe(OH)3胶体]可验证蓄电池的正负极.
思考:通过一个简单实验,证明KMnO4溶液的颜色由MnO4-引起而不是K+引起?(通直流电,阳极区颜色加深)
⑷胶体的凝聚
①加入电解质溶液:之所以能凝聚是因为电解质电离出来的阳离子或阴离子与胶粒所带的负电荷或正电荷电性中和,而使胶粒间的斥力减小,使之凝聚成大颗粒,显然,胶粒带正电,所加电解质中阴离子所带负电荷越高,阴离子浓度越大,凝聚效果越明显,胶粒带负电,所加电解质中阳离子电荷愈高、离子浓度愈大,凝聚效果越明显.
胶粒带正电: PO43->CrO42->SO42->NO3->Cl-
胶粒带负电:Al3+>Fe3+>H+>Ca2+>Mg2+>K+>Na+
例1 要使H2SiO3胶体凝聚,加入下列物质中的哪一种,效果最明显?(物质的量浓度相同,体积相同)
A、Na2SO4 B、MgCl2 C、酒精溶液 D、FeCl3
答案:D
例2 向Fe(OH)3胶体中加入下列哪种物质,先出现浑浊,后又澄清
A、Na3PO4 B、MgSO4 C、盐酸 D、硅酸胶体
解析:加入电解质先凝聚成Fe(OH)3沉淀,后又溶解,只能为盐酸.
加入带相反电荷胶粒的胶体--凝聚原理与加入电解质溶液相同.
加热--温度升高,胶粒碰撞速率加快,从而使小颗粒成为大颗粒而凝聚.
胶体凝聚后所得混合物不能再称为胶体,而叫凝胶.
凝胶--胶粒和分散剂凝聚在一起成为不稳定不流动的冻状物.
常见的重要的凝胶:⑴豆腐--重要的植物蛋白质.
⑵硅胶--硅酸胶体凝聚,在空气中失水成为含水4%的SiO2其表面积大,因而吸附性强,常用做干燥剂、吸附剂及催化剂载体.
思考:⑴各举一例说明胶体特性的应用
①丁达尔现象--(鉴别胶体与其它分散系)
②电泳现象--(判断胶粒带何种电荷)
③不能透过半透膜--(提纯净化胶体)
④凝聚--(生产豆腐、硅胶、长江三角洲的形成)
⑤吸咐性--(河水净化、Al(OH)3胶体可漂白)
⑵除去大气中的灰尘,往往通过高压电,而使之聚集沉降,这是利用了胶体的
A、丁达尔现象 B、电泳 C、凝聚
正确答案为:B
1. 胶体制备--中学常用凝聚法
(1)Fe(OH)3胶体:饱和FeCl3溶液加到沸水中煮沸即得,利用了盐类水解原理制得
 Fe3++3H2O
△ Fe(OH)3(胶体)+3H+
Fe3++3H2O
△ Fe(OH)3(胶体)+3H+
思路:制Fe(OH)3胶体时,能否长时间煮沸?(不能,否则要凝聚)
(2)AgI胶体制备:将AgNO3滴入KI溶液或将KI溶液滴入AgNO3溶液,要成功制得AgI胶体关键是:两种溶液浓度均要很低(≤0.01mol/L).一种溶液过量(取10ml),另一种溶液必须少量,只能用滴管滴加8~10滴,否则只能制得AgI沉淀.
同学们头脑里一定存在这样一个问题:胶体的分散质实际上是不溶物,为什么久置并不沉淀下来?
首先要明确:胶粒(分散质)是否是单个分子?一般不可能(除高分子溶液如蛋白质,淀粉等).通常均为分子集合体,即多个分子聚集而成,其次,胶粒半径小→其表面积大→吸附性强,可吸附与组成胶粒相同或相近的阴、阳离子→胶粒带有同种电荷,相互间斥力较大,因而不能凝聚形成沉淀.
例1 AgI胶体制备,若将0.01mol/LAgNO38-10滴逐滴加入到10ml 0.01mol/LKI溶液中,则AgI胶粒吸附较多的I-(KI过量),胶粒带负电,若反之,则AgI胶粒吸附较多的Ag+(AgNO3过量),胶粒带负电.
例2 As2S3胶体制备方法是将稍过量的H2S气体通入到H3AsO3中,
3H2S+2H3AsO3=As2S3+6H2O,As2S3胶粒带负电,则其胶粒最可能吸附较多的离子是:
A、S2- B、As3+ C、HS- D、OH-
 分析:由于其胶粒带负电,吸附较多的肯定是阴离子,因H2S过量,它又是一种弱酸,主要发生一级电离H2S H++HS-,因此,正确答案为C.
分析:由于其胶粒带负电,吸附较多的肯定是阴离子,因H2S过量,它又是一种弱酸,主要发生一级电离H2S H++HS-,因此,正确答案为C.
例3 土壤胶体胶粒带负电,下列化肥施入水稻田中,肥效较差的是:
A、NH4Cl B、NH4HCO3 C、(NH4)2SO4 D、NH4NO3
分析:土壤胶粒带负电(不告诉我们这个条件也应该联想得到:净化浑浊的河水用明矾,即利用Al(OH)3胶体性质,使之凝聚,显然Al(OH)3胶粒带正电,浑浊河水胶粒带负电),因此吸附阳离子(NH4+)能力较强,而不易吸附阴离子,显然NH4NO3中NO3-不易被土壤吸收因而肥效较差.
胶体胶粒所带电荷判断方法:
金属氧化物、氢氧化物胶粒带正电,如Al(OH)3、Fe(OH)3胶体
非金属氧化物、金属硫化物胶粒带负电,如H2SiO3、As2S3胶体.
2、化学性质
(1)金属与盐
如: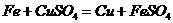
注意:①金属排在金属活动顺序前面且盐要可溶。
②活泼金属与盐溶液反应时,金属先与水反应如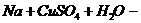
③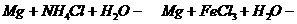 两个反应是置换出H2。
两个反应是置换出H2。
 ④
④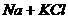 (熔融)
(熔融) 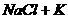 是因为K的沸点比Na低而发生。
是因为K的沸点比Na低而发生。
⑤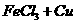 -是因为
-是因为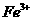 的氧化性而发生。
的氧化性而发生。
(2)盐+酸、盐+碱的反应前面已复习。
(3)盐+盐的反应。
①复分解反应。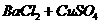 -
-
Al3+ HCO3-(CO32-)
②相互促进水解。 Fe3+(Fe2+) 与 S2-(HS-)
NH4+ SiO32-、AlO2-
ClO-
③氧化-还原反应。 Fe3++I-- Fe3++S2--
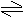 ④不能进行到底(离子大量共存)
④不能进行到底(离子大量共存)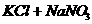
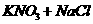
思考:a、FeCl2溶液中加入NaClO溶液有何现象?
(有红褐色沉淀,Fe2+被ClO-氧化,同时Fe3+与ClO-相互促进水解。
b、两种钠盐晶体共热,产生刺激性气味气体,将此气体制成浓溶液与MnO2共热,产生黄绿色气体,问两种钠盐晶体是什么?)
(答:NaCl和NaHSO4)
(4)盐的分解 
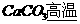
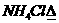
思考:将FeC2O4在空气中加热,可制得FeO,该反应为:
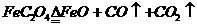 ,问,为何在空气中加热能制得FeO?
,问,为何在空气中加热能制得FeO?
(答:CO2起隔绝O2作用,CO又起还原性保护气作用)
(5)非金属+盐 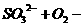
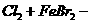
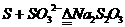
思考:写出Cl2与FeBr2溶液按物质的量比1:1和3:2反应的离子方程式(答:
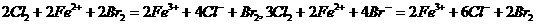 )
)
(6)盐溶液电解(惰性电极)
阴极:阳离子放电顺序 Ag+>Cu2+>H+(一般不考虑H前阳离子放电)
阳极:阴离子放电顺序 S2->I->Br->Cl->OH-(一般不考虑SO42-、NO3-等放电)
[能力训练]
在一定条件下,可实现下图所示物质间变化
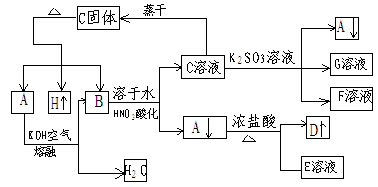
D为黄绿色气体,请填空
(1)A→B化学方程式 __________________
(2)写出下列变化的离子方程式
B→C+A ______________________________
A→D+E ______________________________
C→A+F+G ____________________________
[能力训练答案]
(1)
(2)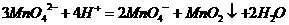
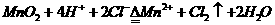
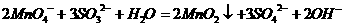
 正盐--酸碱完全中和后的产物如NaCl等。
正盐--酸碱完全中和后的产物如NaCl等。
酸式盐--酸中H+部分被中和的产物如NaHCO3等。
1、分类(1)组成 碱式盐--碱中OH-部分被中和的产物如Cu2(OH)2CO3等。
复盐--一种酸根离子和多种金属离子组成如KAl(SO4)2等。
络盐--如冰晶石(Na3AlF6)。
 强酸强碱盐--不水解(不一定是中性如NaHSO4)
强酸强碱盐--不水解(不一定是中性如NaHSO4)
强酸弱碱盐--水解呈酸性
(2)酸碱性强弱 强碱弱酸盐--水解呈碱性
弱酸弱碱盐--水解溶液酸碱性看酸,碱相对强弱
(二)Ca(OH)2--熟石灰、消石灰
制法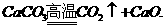 涉及
涉及 应用的有:
应用的有:
1、工业生产无水酒精 2、炼铁、炼钢、生产水泥、玻璃、电石等工业
3、实验室作干燥剂 4、煤中S的固定(其原理是: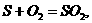
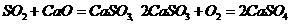 )
)
(一)NaOH--苛性钠、火碱、烧碱
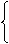 电解饱和食盐水
电解饱和食盐水
1、制法
熟石灰与纯碱反应--既是工业制法,也是实验室制少量NaOH方法。
2、物理性质--掌握极易溶于水(空气中潮解、作干燥剂),放出大量热(配制溶液时先溶解后冷却)。由于强腐蚀性,称量NaOH固体不能在纸上称量,应在玻璃器皿中称量。
3、化学性质:
 CO2
CO2
 酸性氧化物
酸性氧化物  NaOH保存(密封、像皮塞)
NaOH保存(密封、像皮塞)
①氧化物 SiO2
两性氧化物Al2O3
特殊氧化物 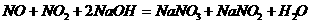
(制HNO3尾气吸收)
②酸碱指示剂
思考:如何证明Na2CO3溶液是否混有NaOH?
(答:取样品加入酚酞试液,然后加过量BaCl2溶液,若红色不褪证明含NaOH,若红色褪去证明不含NaOH)
③某些金属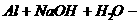 (了解Be、Zn亦能与NaOH溶液反应)
(了解Be、Zn亦能与NaOH溶液反应)
思考:熔化NaOH固体,可选用的坩埚是
A、瓷坩埚 B、铁坩埚 C、Al2O3坩埚 D、石墨坩埚
④某些非金属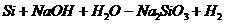 (属置换反应)
(属置换反应)
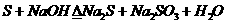
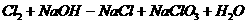 (属歧化反应)
(属歧化反应)
⑤与酸的反应(所有酸)
思考:a、醋酸与NaOH按1:2的物质的量比混合,蒸干灼烧,最后所得固体是什么?
(答:Na2CO3、因为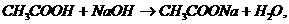
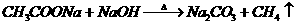 )
)
b、硬脂酸(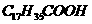 )不溶于水,因而不能使指示剂变色,如何证明其具有酸性?
)不溶于水,因而不能使指示剂变色,如何证明其具有酸性?
(答:在热的NaOH溶液中加入酚酞,然后加入硬指酸,红色逐渐变浅。)
⑥与盐反应:
a、 用于鉴定阳离子存在如:
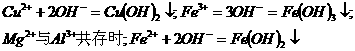
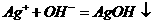
 →
→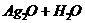
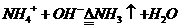 (既用于鉴定NH4+,又用于实验室制NH3)
(既用于鉴定NH4+,又用于实验室制NH3)
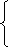 注意两者物质的量之比,如
注意两者物质的量之比,如
b、与酸式盐反应 注意是何种盐,如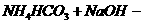 只有当NaOH足量才能生成
只有当NaOH足量才能生成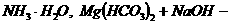 一定生成Mg(OH)2沉淀等。
一定生成Mg(OH)2沉淀等。


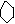 OH ONa
OH ONa

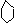
 ⑦酚 +NaOH→ +H2O(证明苯酚具有酸性)
⑦酚 +NaOH→ +H2O(证明苯酚具有酸性)
思考:检验苯酚存在时,可利用如下反应:
 OH
OH
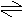

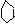 6 +Fe3+ [Fe(C6H5O)6]
3-+6H+,在进行该实验时,适宜在PH值较大还是较
6 +Fe3+ [Fe(C6H5O)6]
3-+6H+,在进行该实验时,适宜在PH值较大还是较
小的条件下进行?能否在强碱性条件下进行?
答:(PH值较大、不能、否则生成Fe(OH)3沉淀)
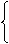 NaOH水溶液发生水解反应
NaOH水溶液发生水解反应
⑧卤代烃
NaOH醇溶液发生消去反应
⑨酯在NaOH存在下的水解反应
4、酸的性质
(1)通性--为什么酸具有相似的化学性质?(电离出来的阳离子均为H+)
①酸碱指示剂反应。
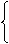 金属活动性顺序氢前的金属
金属活动性顺序氢前的金属
②金属与酸的反应
变价金属只能被H+氧化为低价
③碱性氧化物的反应
④
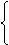 碱的反应--中和反应
CaCO3+HCl-
碱的反应--中和反应
CaCO3+HCl-
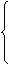 强酸制弱酸如:
强酸制弱酸如:
⑤与某些盐的反应 Ca(ClO)2+H2O+CO2
NaCl+H2SO4(浓)-
不挥发性酸制挥发性酸如:
NaNO3+H2SO4(浓)-
注意:a、特殊的弱酸制强酸CuSO4+H2S=CuS↓+H2SO4
b、多元酸正盐与酸反应转化为酸式盐
思考:BaSO4既不溶于水也不溶于硝酸,但能溶于某种无色液体,所得混合物缓缓倒入水中,又生成白色沉淀,问某种无色液体是什么?
[浓H2SO4、形成Ba(HSO4)2]
(2)还原性酸
FeCl3+HI- Fe2(SO4)3+H2S- Cl2+H2SO3-
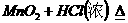
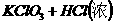 --
--
具体应用:除上述反应外。①测定酸雨PH值,随时间延长,PH值减小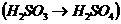 。
。
②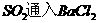 溶液无明显现象,加入
溶液无明显现象,加入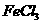 溶液,有白色沉淀(
溶液,有白色沉淀(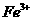 氧化性,将
氧化性,将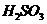 氧化为
氧化为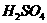 ,形成
,形成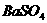 沉淀)。
沉淀)。
③欠置的氢硫酸溶液变浑浊(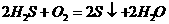 )。
)。
(3)氧化性酸
①Al、Fe遇冷浓HNO3、浓H2SO4钝化。
②C、S、P等非金属均能被热浓HNO3氧化。
③不活泼金属Cu等能被HNO3、浓H2SO4(热)氧化。
(4)既具氧化性又具有还原性酸,如HNO2、H2SO3。
(5)酸的分解
完成下列反应方程式,注明必要条件
 --
--
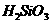 --
-- 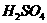 --
-- 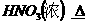
(6)酸的特殊反应
①酸与酸的反应,如H2SO3与硝酸或HClO或H2S的反应
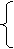 HX与醇→卤代烃
HX与醇→卤代烃
②酸与醇的反应
含氧酸与醇→酯
③酸与酸性氧化物反应,如HF+SiO2-- , HNO3+SO2--
④酸能发生银镜反应, 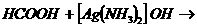
O

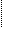

 ↑
↑
思考:硫酸的结构式为H-O-S-O-H其共价键①、②、③、④在不同反应中均可能
④ ③↓② ①
O
断裂。请各举一例,使下列化学键断裂的化学反应。
a、仅①断 b、① ④断 c、① ③断 d、仅②断 e、② ③断
(答案 a、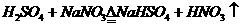
b、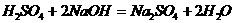 c、
c、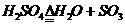
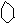



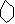

 d、 +
d、 +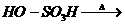
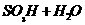
e、 )
)
3、命名(1)无氧酸--氢某酸
 一般称某酸
一般称某酸
(2)含氧酸
化合价不同的另加次、亚、高等
(3)原某酸和偏某酸--中心元素化合价相同。
原某酸--中心元素化合价与分子中-OH数目相等,如H4SiO4、H3AlO3等,原酸失去水分子即为偏酸。
例1 下列反应生成的盐的名称与酸不再对应的是
A、HPO3+KOH(冷)- B、H4SiO4+NaOH-
C、Al(OH)3+NaOH- (答:B、C)
例2 碳与硅同族,硅可形成原硅酸和偏硅酸(即H2SiO3),碳也能形成原碳酸,请写出原碳酸甲酯的结构简式。

 OH
OH
OH
OH

 分析:原硅酸为HO-Si-OH,根据同族元素性质的相似性,原碳酸为HO-C-OH,
分析:原硅酸为HO-Si-OH,根据同族元素性质的相似性,原碳酸为HO-C-OH,
OH OH
与甲醇酯化时,酸提供羟基,醇提供氢。正确答案为C(OCH3)4.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com