
题目列表(包括答案和解析)
1.分子结构:三角锥形 N-锥顶, H-锥底, 键角-107°18′ 极性分子
极性分子
思考:下列气体与对应的液体能进行喷泉实验的是
A.NH3和H2O B.HCl和水 C.Cl2和H2O D.CO2和NaOH溶液
(答: A、B、D)
4.氮的氧化物--N2O(笑气)、NO、N2O3、NO2、N2O4、N2O5,其中属于酸酐的只有N2O3(HNO2)、N2O5(HNO3)
思考:酸分子内或分子间羟基与羟基脱水后形成的物质称为酸酐,则
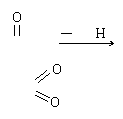
H-C-OH CO,CO能否称为酸酐?为什么?已知硝酸的结构式为
HO-N 则其对应的酸酐的结构式如何表示?
 (不能称为酸酐,因为它是羟基与碳原子相连的氢原子脱水所形成的物质。
(不能称为酸酐,因为它是羟基与碳原子相连的氢原子脱水所形成的物质。

 N-OH + H-O-N
N-O-N (N2O5)+ H2O )
N-OH + H-O-N
N-O-N (N2O5)+ H2O )
(1) NO ①不与酸、碱反应,常温迅速与O2化合2NO + O2 == 2NO2
②碱性条件: NO + NO2 + 2OH- == 2NO2- + H2O
③ NO + CO2 + Na2O2 == Na2CO3 + NO2
思考:NO和CO2的混合气体,通过足量的Na2O2后,剩余气体体积为原来的一半,则NO和CO2的体积比为
A.1:1 B.1:3 C.2:1 D.≤1:1的任意比
(答 D )
④4NO + 3O2 + 2H2O == 4HNO3
⑤实验室制法:3Cu + 8HNO3(稀)== 3Cu(NO3)2+2NO + 4H2O
只能用排水法收集NO,为什么?(排空气NO + O2 - NO2)
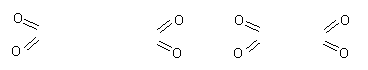
 (2)NO2--不可能为纯净物2NO2 == N2O4
(2)NO2--不可能为纯净物2NO2 == N2O4
强氧化性:NO2 + KI -- NO2 + SO2 -- (古老生产H2SO4方法)
4NO2 + O2 +2H2O == 4HNO3
实验室制法: Cu + 4HNO3(浓)== Cu(NO3)2+ 2NO2 + 2H2O (只能用排空气法收集)
3.N2化学性质
 (1)稳定性--很难与其它物质发生化学反应,为什么?(因为N=N叁键键能很大,很难打断该共价键)
(1)稳定性--很难与其它物质发生化学反应,为什么?(因为N=N叁键键能很大,很难打断该共价键)
(2)一定条件下具有氧化性:
 N2
+ 3H2 ===== 2NH3 --
工业上合成氨
N2
+ 3H2 ===== 2NH3 --
工业上合成氨
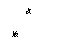
与活泼金属反应 3Mg + N2 ==== Mg3N2 6Na + N2 ==== 2Na3N
(3)具有氧化性 N2 + O2 ==== 2NO
2.N2物理性质:难溶于水,难液化,密度比空气略小--与空气密度相近,只能用排水法收集N2。
思考:请举出与N2密度相近的二种气体以及与CO2密度相近的二种气体。(N2式量为28,则式量为28的还有CO、C2H4,CO2的式量为44,则式量为44的有C3H8和N2O)
1.氮元素存在形态
空气中含大量N2,是工业生产中N2的主要来源。
思考:①工业上如何从空气中分离得到纯净N2? ②实验室如何制取N2?
[①工业制取N2有两种方法:一种是将空气液化,然后蒸发,首先挥发出N2,另一种方法是将木炭在空气中燃烧,将所得气体通过碱洗后得到N2。
 ②实验室制取N2一般也有两种方法:一种是将NH3通过灼热的CuO,
②实验室制取N2一般也有两种方法:一种是将NH3通过灼热的CuO,
2NH3 + 3CuO == N2 + 3Cu + 3H2O得到N2,另一种方法是:NH4Cl饱和溶液和NaNO2饱和溶液混合加热,NH4Cl + NaNO2 == NaCl + N2↑+ 2H2O ]
21、量取25.00mL未知浓度的硝酸溶液,用去10.50mL浓度为0.120mol·L-1NaOH溶液进行滴定,又再用去14.50mL浓度为0.120mol·L-1的KOH继续滴定恰好安全反应,求该HNO3溶液的浓度是多少?
解:C(HNO3)= 0.120mol·L-1
答:(略)
20、(14分)某烧碱样品中含少量不与酸反应的可溶性杂质,为了测定其纯度,进行如下操作:
A、 在250mL容量瓶中定容250mL的烧碱溶液。
B、 用碱式滴定管量取25烧碱液于锥形瓶中,并滴加几滴甲基橙指示剂。
C、 在天平上准确称取W g烧碱样品,在烧杯中用蒸馏水溶解。
D、 将物质的量浓度M mol·L-1的标准硫酸溶液装入酸式滴定管,调整液面并记下开始刻度V1mL。
E、 在锥形瓶下垫一张白纸,开始滴定至终点,并记下终点刻度为 mL。
回答下列实验问题:



 (1)正确操作步骤的顺序是(用序号字母填写) C A B D E
(1)正确操作步骤的顺序是(用序号字母填写) C A B D E
(2)滴定管读取数据时应注意:_ 目光视线应与凹液面最低点齐平__ ____。
(3)操作E中,在锥形瓶下垫一张白纸的目的是: 便于准确判断滴定终点溶液颜色的变化 。
(4)操作D中液面应调整到_____ “0”或“0”刻度以下的其一刻度 。
尖嘴部分应注意_ 充满溶液,无气泡存在__ ____。
(5)滴定终点时PH约为3.1-4.4,终点时锥形瓶中溶液颜色变化是: 黄色变为橙色________。
(6)若酸式滴定管没有使用标准H2SO4溶液润洗,则测定结果将 偏 高 (填“偏高” “偏小” 或“无影响”,其它操作均正确)
(7)该烧碱样品的纯度计算式为: 。
19、(4分)有一学生在实验室测某溶液的PH时,先用蒸馏水润湿PH试纸,然后用洁净干燥的玻璃棒蘸取试液进行检测,该操作方法错误,其原因是: 若 溶 液 不 显 中 性,则和均被稀释,测出的不是原溶液对应的PH 那么,该操作方法 不 一 定 (填“一定”或“不一定”)产生误差。
18、(4分)某可溶性盐的化学式XmYn(m≠n),将一定量的该盐溶解于适量的水中。
(1)若测得溶液的pH为3,则该盐与水反应的离子方程式可能为
Xn+ + n H2O  X(OH)n + n H+
。
X(OH)n + n H+
。
(2)若该盐水溶液的pH为11,则其与水反应的离子方程式可能为
Ym- + H2O  HY(m-1)- + OH-
。
HY(m-1)- + OH-
。
17、(4分)已知BiCl3水解生成BiOCl(俗称珠光白,是难溶于稀酸的物质。)
(1)写出BiCl3水解方程式: BiCl3
+ H2O  BiOCl +2 HCl ;
BiOCl +2 HCl ;
(2)配制BiCl3溶液时,应先将其溶解于适量的 盐 酸 中。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com