
题目列表(包括答案和解析)
2. 下列说法错误的是
A. 铅笔不含铅 B. 纯碱不是碱 C. 水银不含银 D. 重水不是水
1. 火药是我国古代的“四大发明”之一,我国最早发明的黑火药后来传入了波斯,波斯人将其中一种成份称为“中国盐”。这种成份的化学式是
A. 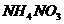 B.
B.  C.
C. 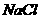 D.
D. 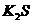
3. NO3-的鉴定:取样品(固体或浓溶液)+ 浓H2SO4
+ 铜片 若有红棕
NO3-的鉴定:取样品(固体或浓溶液)+ 浓H2SO4
+ 铜片 若有红棕
色气体生成,则含有NO3-(若样品为较稀溶液,管口有红棕色气体生成)若样品是极稀的溶液,应加热浓缩后才能进行上述鉴定实验。
[能力训练]
将一生锈的铁片(铁锈成份以Fe2O3计),放入稀HNO3中,反应结束后,收集到NO气体11.2L(标况),溶液中还剩下5g固体残渣,过滤后,向溶液中通入35.5gCl2,恰好将溶液中的Fe2+全部氧化,求铁片中铁锈的质量分数。
[能力训练答案]20.5%
2.硝酸盐分解:按金属活动顺序K~Na的硝酸盐分解得亚硝酸盐和O2
Mg~Cu生成金属氧化物、NO2、O2、Hg~Ag生成金属、NO2、O2
思考:(1)某金属的硝酸盐受热分解,生成金属氧化物、NO2和O2,其中NO2和氧气的体积比为8:1,则金属元素的化合价。
 A.升高 B.降低 C.不变 D.无法确定
A.升高 B.降低 C.不变 D.无法确定
(解析:关键是利用电子得失守恒原埋, N→N,O→O,则形成1mol O2失去4mol电子,同时生成8molNO2必得8mol电子,金属元素的化合价必升高)
|
 (2)已知三种硝酸盐受热分解:2NaNO3 == 2NaNO2 + O2↑
(2)已知三种硝酸盐受热分解:2NaNO3 == 2NaNO2 + O2↑
2Cu(NO3)2
==2CuO + 4NO2↑ + O2↑ 2AgNO3 ==
2Ag + 2NO2↑ + O2↑由上述三种盐的一种或几种组成的物质,受热分解进生成mL气体,被水充分吸收后剩余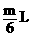 气体,符合这一条件的几种可能组合是________、________、___________、_________。(有几种组合填几种,不必填满,亦可补充)
气体,符合这一条件的几种可能组合是________、________、___________、_________。(有几种组合填几种,不必填满,亦可补充)
(解析:①NaNO3分解产生mLO2不能被水吸收,不可能是单一的NaNO3
②Cu(NO3)2分解产生mL NO2和O2且体积比为4:1,能被水完全吸收,无气体剩余,不可能是单一的Cu(NO3)2
③AgNO3分解产生mLNO2和O2,但其体积比为2:1,被水吸收后恰好剩余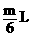 O2,可以是单一的AgNO3,若①与②组合,
O2,可以是单一的AgNO3,若①与②组合,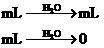 则按一定比例混合可剩余
则按一定比例混合可剩余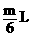 。若①与③组合
。若①与③组合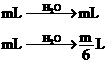 。无论按什么比例混合,剩余气体一定大于
。无论按什么比例混合,剩余气体一定大于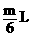 ,同理②与③组合剩余气体一定小于
,同理②与③组合剩余气体一定小于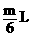 ,若①②③组合同样可以剩余
,若①②③组合同样可以剩余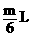 ,因此有三种组合。)
,因此有三种组合。)
主要了解这几方面的内容:
1.高温时表现强氧化性,如黑火药的爆炸就是KNO3表现氧化性
|
|
 由于分解产生NO2又溶解到HNO3里,而呈黄色。久置的试剂颜色变化的较多。如:
由于分解产生NO2又溶解到HNO3里,而呈黄色。久置的试剂颜色变化的较多。如:
Na2O2、 、Fe2+化合物、AgX、AgNO3等。
思考:久置变黄的硝酸如何除去黄色?
(通入过量O2,不能加水,否则浓HNO3变成稀HNO3)
(2)强氧化性--越浓氧化性越强
①使Fe、Al钝化 ②除Au 和Pt可溶解绝大多数金属。要使Au、Pt溶解可用王水
思考:①王水、实验室制取CH4、C2H4均存在1:3关系,问这1:3是指体积、质量还是物质的量?
②(王水中浓HNO3和浓盐酸物质的量比1:3,制CH4无水CH3COONa与碱石灰质量比约为1:3,制C2H4酒精与浓H2SO4体积比为1:3)
③5.6g铁粉与100g稀HNO3恰好反应,求硝酸的质量分数。
(Fe与硝酸反应,应有以下几种情况:a、Fe + 4HNO3 = Fe(NO3)3 + NO↑+ 2H2O,
A% = 25.2% b、3Fe + 8HNO3 = 3Fe(NO3)2 + 2NO↑+ 4H2O,A% =16.8%
C、所得产物为Fe(NO3)3和Fe(NO3)2混合物,则应在16.8~25.2%之间)
④氧化非金属,如C、S、P,且氧化到最高价
⑤某些化合物,如S2-、SO42-、Fe2+、I-等
(3)与有机物的反应
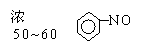
 ① + HNO3
+ H2O
① + HNO3
+ H2O
进行该实验的操作步骤?实验现象?为何制得的硝基苯为谈黄色?怎样将淡黄色除去得到纯硝基苯?
②与醇、纤维素的酯化
③与蛋白质发生黄蛋白反应
|
(1)实验室制法 NaNO3 + H2SO4(浓)==== NaHSO4 + HNO3↑
实验室制HNO3的原理与制HCl完全相同,为什么制HNO3的产物只能为NaHSO4而不是Na2SO4?制HNO3发生装置是否与制Cl2完全相同?
(因为若生成Na2SO4必强热,这时HNO3亦分解。不同,一般制HNO3只能用曲颈瓶,若用与制Cl2相同的装置,橡皮塞应用铝箔包起来。)
(2)工业制法--氨的催化氧化法
①氨的氧化--氧化炉
|
(高温NO不能与O2化合,即2NO2 ===2NO + O2)
③尾气吸收--用NaOH溶液
④稀NHO3浓缩--吸水剂Mg(NO3)2或浓H2SO4再蒸馏。
思考:吸水剂能否用MgCl2或P2O5?
(不能用MgCl2,因为蒸馏时HNO3中含HCl,可用P2O5,因形成H3PO4也是不挥发性酸)
例:氨氧化法可制得50%的硝酸。加脱水剂可进一步制得90%的硝酸,两种产品的质量比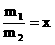 (m1、m2分别为50%的硝酸溶液和90%的硝酸溶液质量)。若以17吨液氨为原料生产硝酸
(m1、m2分别为50%的硝酸溶液和90%的硝酸溶液质量)。若以17吨液氨为原料生产硝酸
(1)导出理论上所需水量y(吨)与质量比x数学关系式(假定NH3转化率是100%)
(2)根据导出关系式求出只生产50%的硝酸所需水的量和只生产90%硝酸所需水的量(吨)
(3)质量比x为多少时,进出水的量保持平衡,此时两种产品总质量为多少吨?
解析:这是一道结合数学知识解决化工生产的典型例题,高考《考试说明》明确指出:
要具备用数学知识解决化学问题的能力。
本题首先要导出需要水的量与两种硝酸质量比的函数关系:
两种产品中含水为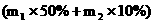 吨,这是否理论上需要水的量?不是,因为在NH3 + 2O2 = HNO3 + H2O反应中,17吨氨除完全转化为63吨硝酸外,还生成18吨水,因此
吨,这是否理论上需要水的量?不是,因为在NH3 + 2O2 = HNO3 + H2O反应中,17吨氨除完全转化为63吨硝酸外,还生成18吨水,因此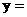
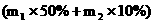 -18,现在的问题是如何将m1、m2转化为x,根据题意:
-18,现在的问题是如何将m1、m2转化为x,根据题意:
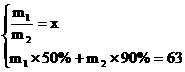 代入
代入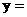
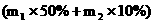 -18
-18
得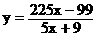
解答第二问,关键是抓住“根据导出关系式”,而不是利用化学方程式求解。如何根据导出关系式求出需要水的量?还要抓住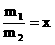 ,当只生产50%硝酸时,即m2=0,若m2=0,
,当只生产50%硝酸时,即m2=0,若m2=0,
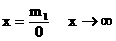 即
即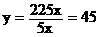 吨,需加入45吨水。当只生产90%硝酸时,m1=0,
吨,需加入45吨水。当只生产90%硝酸时,m1=0,
x=0,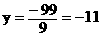 吨,这-11吨什么意思?即不需要加水,反而脱去11吨水,才能得到90%的硝酸。
吨,这-11吨什么意思?即不需要加水,反而脱去11吨水,才能得到90%的硝酸。
第三问比较简单,当进出水的量保持平衡,即y=0,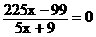 ,
,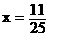
利用方程组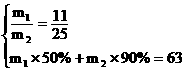 求出
求出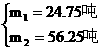
两种产品的总质量为24.75+56.25=81吨
2.化学性质
 (1)水解:NH4+ + H2O == NH3·H2O + H+
(1)水解:NH4+ + H2O == NH3·H2O + H+
思考:①请写出NH4+在D2O中水解的离子方程式
 (NH4+
+ D2O == NH3·HDO + D+ 或NH3·HDO + D3O+)
(NH4+
+ D2O == NH3·HDO + D+ 或NH3·HDO + D3O+)
②试用平衡移动原理解释下列现象:氨水加入Mg2+溶液出现白色沉淀Mg(OH)2而Mg(OH)2加入到饱和NH4Cl溶液沉淀又能溶解。
③Mg(OH)2能溶于饱和NH4Cl溶液有两种解释,一种是:

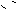 Mg(OH)2(s)== Mg2+ + 2OH-,NH4+ + H2O
== NH3·H2O
+ H+,H+与OH-中和,促使Mg(OH)2的溶解平衡移动而溶解,另一种解释是:
Mg(OH)2(s)== Mg2+ + 2OH-,NH4+ + H2O
== NH3·H2O
+ H+,H+与OH-中和,促使Mg(OH)2的溶解平衡移动而溶解,另一种解释是:
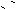
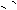 Mg(OH)2(s)== Mg2+ + 2OH-,OH- + NH4+
==NH3·H2O,使Mg(OH)2 溶解。
Mg(OH)2(s)== Mg2+ + 2OH-,OH- + NH4+
==NH3·H2O,使Mg(OH)2 溶解。
试问:你能否只用一种试剂验证哪种解释合理?
|
(2)与碱反应:NH4+ + OH- == NH3↑+ H2O
注意:①该反应要生成NH3,必须要有加热条件,否则只能写成NH3·H2O
②该反应有何重要应用?一是实验室利用该反应来制取NH3,二是利用该反应检验或鉴定NH4+,请你说出鉴定NH4+方法?
(取样品加入NaOH溶液加热,若有使湿润的红色石蕊试纸变蓝的气体产生,即含NH4+)
|
(NH)2S == 2NH3 + H2↑+ S
若为氧化性酸形成的铵盐,受热分解发生氧化-还原反应,产物复杂一般不要求同学们掌握。
思考:①铵盐分解的实质是NH4+提供质子(H+)给酸根离子,则NH4F、NH4Cl、NH4Br、NH4I四种铵盐的热稳定性由大到小的顺序是_____________________
(NH4I> NH4Br> NH4Cl>NH4F,因为HF最弱,F-最易分解)
②硫酸铵受分解的产物是N2、SO2、NH3、H2O和SO3,问该反应中每转移1mol电子,有多少摩(NH4)2SO4分解?
(首先写出反应方程式 4(NH4)2SO4 == N2 + 3SO2
+ SO3 + 6NH3 + 7H2O,根据反应式,每生成1mol/N2转移6mol电子,即有4mol(NH4)2SO4分解,则转移1mol电子应有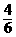 即
即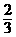 mol(NH4)2SO4分解)
mol(NH4)2SO4分解)
1.结构:NH4+与酸根离子组成,含离子键、共价键和配位键,属于离子晶体,极易溶水,且溶于水吸热。
3.实验室制法
|
2NH4Cl + Ca(OH)2 === CaCl2 + 2NH3↑+ 2H2O
(2)反应装置:与制取O2、CH4完全相同
思考:收集NH3时,试管口放一团棉化,起什么作用?
(防止氨气与空气对流,以便收集到较纯的NH3)
2.化学性质
 (1)NH3 + H2O == NH3·H2O ==NH4+
+OH- (中学唯一的碱性气体)
(1)NH3 + H2O == NH3·H2O ==NH4+
+OH- (中学唯一的碱性气体)
思考:①为什么能在浓氨水中加入NaOH固体可制取NH3?
(增大OH-浓度使氨水中平衡向左移动)
②氨水成分与液氨是否相同?给氨水加热[OH-]、电离度如何变化?若煮沸呢?已知使稀氨水PH值减小,电离度增大,则[NH4+]如何变化?(不同,氨水混合物,液氨纯净物。加热[OH-]、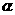 均增大,若煮沸,氨水挥发,[OH-]要减小。[NH4+]可能增大,也可能减小)
均增大,若煮沸,氨水挥发,[OH-]要减小。[NH4+]可能增大,也可能减小)
(2)酸 NH3 + H+ == NH4+ (挥发性酸反应有白烟生成)
(3)盐溶液 NH3 + H2O + Fe3+ -- NH3 + H2O + Al3+ -- [制Al(OH)3]
Ag+ + NH3 + H2O -- (先沉淀后溶解)
NH3 + H2O + CO2 + NaCl == NaHCO3↓+ NH4Cl (侯氏制碱)
|
4 NH3 + 3O2(纯) === 2N2 + 6H2O
|
2 NH3 + 3CuO === 3Cu + N2 + 3H2O
 (5)液氨自电离NH3 + NH3 == NH4+ + NH2-
(5)液氨自电离NH3 + NH3 == NH4+ + NH2-
思考:已知NH4+与H3O+(H+)相当,NH3与H2O相当,NH2-与OH-相当。
N3-(NH2-)与O2-相当。试完成下列反应方程式
|
|
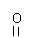 ③M(NH2)2--(M为金属) ④NH4Cl + MO --
③M(NH2)2--(M为金属) ④NH4Cl + MO --
(答:2Na + 2NH3 == 2NaNH2 + H2,
|
|
 CH3COOC2H5
+ NH3 CH3-C-NH2 + CH3CH2OH
CH3COOC2H5
+ NH3 CH3-C-NH2 + CH3CH2OH
|
2NH4Cl + MO == MCl2 + 2NH3↑+ H2O)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com