
题目列表(包括答案和解析)
5.用特殊方法把固体物质加工到纳米级(1 nm-100 nm,1nm=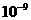 m)的超细粉末粒子,
m)的超细粉末粒子,
然后制得纳米材料。下列分散系中的分散质的粒子直径和这种粒子具有相同数量级的是( C )
A.NaCl溶液 B.泥浆水 C.Fe(OH)3胶体 D.油水混合物
4.在pH=1的无色透明溶液中能大量共存的离子组是( A )
A.NH4+、Mg2+、SO42-、Cl- B.Ba2+、K+、OH-、NO3-
C.Al3+、Cu2+、SO42-、Cl- D.Na+、HS-、K+、SO42-
3.下列有关晶体的说法中,正确的是( C )
A.分子晶体中一定存在共价键 B.离子晶体中不一定存在离子键
C.原子晶体的熔、沸点均较高 D.金属晶体的硬度均较大
2.用铂电极电解某溶液一段时间,该溶液浓度增大而pH减小,该溶液是( C )
A.NaOH B.CuCl2 C.H2SO4 D.CuSO4
1.工业上生产硫酸,回收尾气中SO2气体,选用的试剂是( A )
A.NH3·H2O B.NaOH C.Ca(OH) 2 D.浓H2SO4
29、用废铁屑与稀硫酸溶液反应,可制得FeSO4。在10℃和50℃时,FeSO4在 100 g水中的溶解度分别为20.5 g和 48.6 g,常温下,从溶液中析出的晶体是FeSO4·7H2O。现取 200 ml 0.500 mol/L H2SO4溶液,将 8.00 g废铁屑加入到上述稀H2SO4中,并不断搅拌,反应约 15 min后过滤。滤液在80℃经蒸发、浓缩,冷却至10℃后析出FeSO4·7H2O晶体。
(1)若加入的废铁不是粉状而是块状,对反应的影响是 ;
A.会降低反应速率 B.会减少绿矾产量
C.需要加热才反应 D.将增大反应体系的PH值
(2)反应 15 min后过滤,其目的是 ;
(3)滤液中除 FeSO4和可能未反应完全的H2SO4外,最可能存在的无机杂质是 。它是由 而产生的,其检测的方法是 ;
(4)设 H2SO4与铁完全反应,当将滤液蒸发浓缩后,冷却至 50℃时,溶液的体积约为50.0 ml,该溶液是否达饱和?试通过计算加以说明。(50℃时,FeSO4饱和溶液的密度为1.36 g/cm3)
(5)若要计算在80℃下将溶液蒸发至体积为70.0 ml,再冷却至10℃时,所得到的FeSO4 ·7H2O的质量,你认为 (填编号),并简述所选之理由。答: .
A.前面提供的数据已经足够
B.还需要提供 10℃时饱和溶液的密度: 1.42 g/cm3
C.还需要提供 80℃时溶液的密度:1.30 g/cm3
D.还需要提供结晶后剩余溶液的体积:52.0 ml
(6) 根据第(5)小题你的选择项(如选A则直接计算,如选B、C或D则可选用其数据)计算从10℃ 50.0 ml溶液中结晶析出的FeSO4·7H2O的质量。(本大题计算结果保留3位有效数字)。
28、在一固定容积的密闭容器中,保持一定温度,在一定条件下进行以下反应:
A(g) +
2B(g)  3C(g);已知加入1 mol A和3 mol B且达到平衡时生成a mol C。
3C(g);已知加入1 mol A和3 mol B且达到平衡时生成a mol C。
(1) 达到平衡时C在反应混合气体中的物质的量百分含量为 (用含a关系式表示);
(2) 在相同实验条件下,若在同一容器中改为加入2 mol A和6 mol B,达到平衡后,C的物质
的量为 (用含a关系式表示)。此时C在混合气体中的物质的量百分含
量 (填增大、减少或不变);
(3) 在相同实验条件下,若在同一容器中改为加入2 mol A和8 mol B,若要求平衡后C在反应
混合气体中的物质的量百分含量不变,还应加入 C mol。
(4) 若在同一容器中,加入n mol A和3n mol B,则平衡时C的物质的量为m mol。若改变实验
条件,可以使C的物质的量在m-2m间变化,那么n、m的取值范围是
(用含字母n、m的关系式表示)。
(5) 若上述可逆反应一开始就从逆向建立平衡,达到平衡后,再将C物质的量加倍,则C的分
解率 (填“增大”、“减小”或“不变”)。
27、(2+3+3=8分)现有AlCl3和FeCl3混合溶液,其中Al3+和Fe3+的物质的量之和为0.1 mol,在此溶液中加入90 mL 浓度为4 mol/L的NaOH溶液,使其充分反应,设Al3+的物质的量与总物质的量的比值为x。

(1) 根据反应的化学方程式计算,当x=0.4 时,溶液中产生的沉淀是什么?物质的量是多少?
(2) 计算沉淀中只有Fe(OH)3的x取值范围,请在图中画出沉淀总量(mol)随x(0→1)变化的曲线。
(3) 若Al3+和Fe3+的物质的量之和为A mol(A为合理取值),其他条件不变时,求沉淀中同时有Fe(OH)3、Al(OH)3的x的取值范围和各沉淀的物质的量(用含有A、x的式子表示)。
附加题:
26、250C时,若体积为Va、pH=a的某一元强酸与体积为Vb、pH=b的某一元强碱混合,恰好中和,且已知Va<Vb和a=0.5b.请填写下列空白:
(1) a值可否等于3(填“可”或“否”) ,其理由是 ;
(2) a值可否等于5(填“可”或“否”) ,其理由是 ;
(3) a 的取值范围是 。 (1x4+2=6分)
25、降凝剂H可以降低油品的凝固点,它是一种高分子聚合物,其合成路线可以设计如下:

请回答下列问题:
(1)指出反应类型:① ,② 。
(2)写出结构简式:D , H 。
(3)写出E→F的化学方程式: 。(2+2+2+2=8分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com