
题目列表(包括答案和解析)
25.
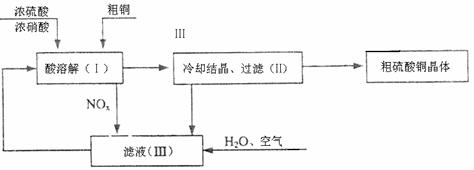 (10分)以浓硫酸、浓硝酸、粗铜、水和空气为原料可制得硫酸铜(CuSO4·5H2O)。制取硫酸铜晶体的过程如下图所示。
(10分)以浓硫酸、浓硝酸、粗铜、水和空气为原料可制得硫酸铜(CuSO4·5H2O)。制取硫酸铜晶体的过程如下图所示。
回答下列问题:
⑴配平在滤液(Ⅲ)中发生反应的化学主程式:
NOx+ H2O+ O2= HNO3。
⑵写出制取硫酸铜的总反应方程式 。
⑶在上述生产过程中,被循环使用的物质是 。
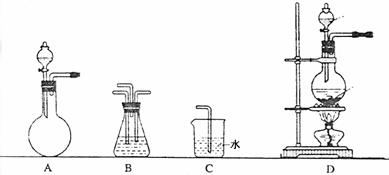 ⑷请你选用下列适宜的装置来模拟上述生产过程。将它们的编号填入方框:
⑷请你选用下列适宜的装置来模拟上述生产过程。将它们的编号填入方框:
24.(8分)根据实验要求,回答下列问题:
⑴精制硫酸亚铁晶体(含少量不溶性杂质)时,将晶体溶于水后,为什么还需加热到50℃~80℃?为减少硫酸亚铁的损失,应采取什么分离方法?
、
。
⑵某溶液中含有OH–、CO32–、SO42–三种阴离子,要求只取一次待测液就能将阴离子都检验出来,试设计一种简便的检验方法(不选用指示剂)。
。
23.(6分)有一瓶澄清的溶液,其中可能含有NH4+、K+、Na+、Mg2+、Ba2+、Al3+、Fe3+、NO3-、SO42-、CO32-、C1-和I-。取该溶液进行以下实验:
⑴用pH试纸检验,表明溶液呈强酸性;
⑵取部分溶液,加入少量CCl4及数滴新制的氯水,经振荡后,CCl4层呈紫红色;
⑶另取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过
程中及滴加完毕后,溶液中均无沉淀生成;
⑷取部分上述碱性溶液加热,加Na2CO3溶液,有白色沉淀生成;
⑸将⑶得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实确定:在该溶液中肯定存在的离子是 ,肯定不存在的离子是 ,不能确定是否存在的离子是 。
22.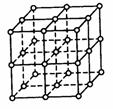 (12分)如右图,直线交点处的圆圈为NaCl晶体中Na+离子或Cl-离子所处的位置。这两种离子在空间三个互相垂直的方向上都是等距离排列的。
(12分)如右图,直线交点处的圆圈为NaCl晶体中Na+离子或Cl-离子所处的位置。这两种离子在空间三个互相垂直的方向上都是等距离排列的。
⑴请将其中代表Na+离子的圆圈涂黑(不必考虑体积大小),以完成
NaCl晶体的结构示意图。
⑵晶体中,在每个Na+离子的周围与它最接近的且距离相等的Na+
离子共有_______个。
⑶晶体中每一个重复的结构单元叫晶胞。在NaCl晶胞中正六面体
的顶点上、面上、棱上的Na+或Cl-离子为该晶胞与其相邻的晶胞所共有。一个晶胞中,Cl-离子的个数等于______,Na+离子的个数等于_______。
⑷设NaCl的摩尔质量为M g/mol,食盐晶体的密度为ρ g/cm3,阿伏加德罗常数为NA。则食盐晶体中两个距离最近的钠离子中心间的距离为 cm。
21. (10分)如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸(B中的电极为石墨),C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
(10分)如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸(B中的电极为石墨),C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
⑴电源A上的a为______________极。
⑵滤纸B上发生的总化学方程式为:
。
⑶欲在电镀槽中实现铁上镀锌,接通K点,使c、d两点
短路,则电极e上发生的反应为 ,
电极f上发生的反应为: ,
C槽中盛放的镀液可以是 。
(只要求填两种电解质溶液)。
20.(4分)0.3 mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧生成固态三氧化二硼和液态水,放出649.5 kJ的热量,其热化学方程式为 ;
又已知H2O(液)=H2O(气);ΔH=+44 kJ/mol,则标准状况下,22.4 L乙硼烷完全燃烧生成水蒸气时放出的热量为 kJ。
19.(10分)选择以下物质,填写下列空白(填序号)。
A.干冰 B.金刚石 C.氯化铵 D.氟化钙 E.固体碘 F.烧碱
⑴熔化时不需要破坏化学键的是 。
⑵熔化时需要断裂共价键的是 。
⑶熔点最低的是 。
⑷晶体中存在分子的是 。
⑸晶体中既有离子键又有共价键的是 。
18.下列各组物质中,前者是欲检验在放置过程中是否已部分氧化变质的物质(都是溶液),后者是验证时使用的试剂,其中正确的是( BC )
A.Na2SO3,BaCl2 B.FeCl2,NH4SCN C.NaI,淀粉 D.苯酚,FeCl3
第Ⅱ卷(非选择题,共78分)
17.下列可以证明铁的还原性比铜强的实验方案是( AD )
A.将铁棒插入硫酸铜溶液
B.将铜棒插入氯化铁溶液
C.铁作阴极、铜作阳极均插入硫酸铜溶液中电解
D.铁片、铜片用导线连接后,两片浸入稀硫酸
16.硒有两种同素异形体:灰硒和红硒。灰硒溶于三氯甲烷,红硒溶于二硫化碳,它们都不溶于水,则灰硒和红硒的晶体是( B )
A.原子晶体 B.分子晶体 C.金属晶体 D.以上均有可能
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com