
题目列表(包括答案和解析)
9.现有KCl、KBr的混合物3.87g,将混合物全部溶解于水,并加入过量的AgNO3溶液,充分反应后产生6.63g沉淀物,则原混合物中钾元素的质量分数为
A.0.241 B.0.259 C.0.403 D.0.487
8.将固体NH4I置于密闭容器中,在某温度下发生下列反应:
①HN4I(固) NH3(气)+HI(气);②2HI(气)
NH3(气)+HI(气);②2HI(气) H2(气)+I2(气)。当反应达到平衡时,c(H2)=0.5
mol·L-1,c (HI)= 4 mol·L-1,则NH3的浓度为
H2(气)+I2(气)。当反应达到平衡时,c(H2)=0.5
mol·L-1,c (HI)= 4 mol·L-1,则NH3的浓度为
A.3.5 mol·L-1 B.4 mol·L-1 C.4.5 mol·L-1 D.5 mol·L-1
7.X和Y两元素组成的化合物A和B,A的分子组成为XY2,其中X的质量分数为44.1%,B中X的质量分数为34.5%,则B的分子式为
A.X2Y B.XY3 C.XY D.X3Y
6.3g镁、铝合金与100mL稀硫酸恰好完全反应,将反应后所得溶液蒸干,得到无水硫酸盐17.4g,则原硫酸溶液的物质的量浓度为
A.1 mol/L B.1.5 mol/L C.2mol/L D.2.5mol/L
5.已知2H2O(l)=2H2(g)+O2(g);ΔH=+517.6 kJ·mol-1 CH4(g)+2O2(g)=2H2O(l)+CO2(g);ΔH=-890.3 kJ·mol-1,将1 g H2和1 g CH4分别完全燃烧,放出热量之比为
A.1∶3.4 B.1∶1.7 C.2.3∶1 D.4.6∶1
4.只给出下列甲中和乙中对应的量,可以组成一个物质的量的公式的是
|
|
① |
② |
③ |
④ |
⑤ |
|
甲 |
物质微粒数 |
标准状况气体摩尔体积 |
固体体积 |
非标况物质质量 |
溶液质量分数 |
|
乙 |
阿伏加德罗常数 |
标准状况气体体积 |
固体密度 |
物质的摩尔质量 |
溶液体积 |
A.①② B.①②③ C.①②④ D.①②⑤
3.在标准状况下,a L HCl 气体溶于1000g水中,得到盐酸的密度为b g/cm3,则该盐酸的物质的量浓度为
A.a/22.4mol/L B.ab/22400mol/L
C.ab/(22400+36.5a)mol/L D.1000ab/(22400+36.5a)mol/L
2.由NaH2PO4脱水形成聚磷酸盐Na200H2P200O601,共脱去水分子的数目为
A.198个 B.199个 C.200个 D.201个
1.设NA代表阿伏加德罗常数,下列说法正确的是
A.2.4g金属镁变成镁离子时失去的电子数目的0.1NA
B.2g氢气所含原子数目为NA
C.25℃,压强为1.01×105Pa时,11.2L氮气所含的原子数目为NA
D.17g氨气所含电子数目为10 NA
24.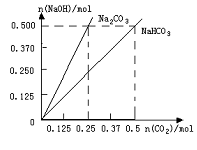 (10分)现有NaOH(s)、水、大理石和盐酸,制取33g纯NaHCO3。请参照物质的溶解度表回答下列问题:
(10分)现有NaOH(s)、水、大理石和盐酸,制取33g纯NaHCO3。请参照物质的溶解度表回答下列问题:
|
25℃ |
溶解度/g |
|
NaOH |
110 |
|
NaHCO3 |
9 |
|
Na2CO3 |
30 |
(1)制取过程中反应的化学方程式为:
。
(2)若提供100g水则需NaOH的物质的量为 mol。
(3)简述实验的操作过程:
(4)在如图反映上述实验过程的图象中,标出A点(即当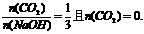 125mol时)的位置,此时所得盐及其物质的量为 。
125mol时)的位置,此时所得盐及其物质的量为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com