
题目列表(包括答案和解析)
5.下列叙述正确的是
A. 同主族元素的原子半径越大,熔点越高
B.稀有气体原子序数越大,沸点越高
C.分子间作用力越弱,分子晶体的熔点越低
D.同周期元素的原子半径越小越易失电子
4.下列说法中正确的是
A. 冰熔化时,分子中H-O键发生断裂
B.原子晶体中,共价键越强,熔点越高
C.分子晶体中,共价键键能越大,该分子晶体的熔沸点一定高
D.分子晶体中,分子间作用力越大,该物质越稳定
3.下列各组物质的晶体中,化学键类型相同,晶体类型也相同的是
A. SiO2和SO2 B.CO2和H2O
C.NaCl和HCl D.CCl4和HCl
2.美国科学家发现的C60是一种新的分子,它具有空心的类似足球的结构,被称为“分子足球”。最近日本科学家认为世界上还存在着另一种“分子足球”-N60 ,具有相似的结构,并且在高温或机械撞击后,其积蓄的巨大能量会在一瞬间释放出来。对于N60 ,下列说法中正确的是
A. N60是由共价键构成的空心圆球面结构,所以它是一种原子晶体
B.N60和14N都是氮的同位素
C.N60没有同素异形体
D.N60的发现开辟了能源世界新天地,将来有可能会成为有发展前途的高能燃料
1.下列过程中,共价键被破坏的是
A.碘升华 B.溴蒸气被木炭吸附
C.酒精溶于水 D.HCl气体溶于水
24.(10分)现有AlCl3和FeCl3混合溶液,其中Al3+和Fe3+的物质的量之和为0.1 mol,在此溶液中加入90 mL 浓度为4 mol/L的NaOH溶液,使其充分反应,设Al3+的物质的量与总物质的量的比值为x。
 (1)根据反应的化学方程式计算,当x=0.4 时,溶液中产生的沉淀是什么?物质的量是多少?
(1)根据反应的化学方程式计算,当x=0.4 时,溶液中产生的沉淀是什么?物质的量是多少?
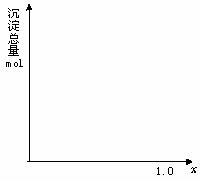
(2)计算沉淀中只有Fe(OH)3的x取值范围,请在图中画出沉淀总量(mol)随x(0→1)变化的曲线。
(3)若Al3+和Fe3+的物质的量之和为A mol(A为合理取值),其他条件不变时,求沉淀中同时有Fe(OH)3、Al(OH)3的x的取值范围和各沉淀的物质的量(用含有A、x的式子表示)。
23.(10分)在常温常压下,把a mol的NH3和O2的混合气充入密闭容器中,在催化剂存在下加热 ,使其充分反应,然后恢复到原来的温度和压强。
(1)写出容器内NH3被氧化和形成HNO3的化学方程式。
(2)若原混合气中O2的体积分数为x,最后在容器中生成的HNO3为ymol。
 请填写下表.
请填写下表.
|
X的取值范围 |
用x表示的y值表示式 |
|
|
|
|
|
|
|
|
|
|
|
|
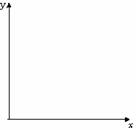
(3)在坐标图上画出y=f(x)的关系曲线.
22.(10分)聚氯乙烯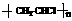 是最早工业化生产的最重要塑料品种之一,其具有价格低廉、难燃等优点,因此产量仅次于聚乙烯居第二位。但是,其加工过程中需要使用多种有毒添加剂。有毒的添加剂会渗出对人类造成危害;另外,其燃烧值低,聚乙烯
是最早工业化生产的最重要塑料品种之一,其具有价格低廉、难燃等优点,因此产量仅次于聚乙烯居第二位。但是,其加工过程中需要使用多种有毒添加剂。有毒的添加剂会渗出对人类造成危害;另外,其燃烧值低,聚乙烯 等烯烃聚合物燃烧产生的能量与燃油相当,而聚氯乙烯产生的能量仅与纸张相当,且有剧毒的二噁英的生成(二噁英是目前对人类最毒的物质)。
等烯烃聚合物燃烧产生的能量与燃油相当,而聚氯乙烯产生的能量仅与纸张相当,且有剧毒的二噁英的生成(二噁英是目前对人类最毒的物质)。
(1)计算聚氯乙烯中氯的质量分数 。
(2)聚氯乙烯、聚乙烯的原料都为石油。其中,聚乙烯中的 都来自于石油;而聚氯乙烯中的
都来自于石油;而聚氯乙烯中的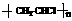 除来自于石油外,还有HCl。现有1t石油,试计算可得出多少吨聚乙烯和聚氯乙烯(理论上假设石油的全部成分为碳和氢,并且在生产聚乙烯、聚氯乙烯的过程中没有碳原子和氢原子的损失)
。
除来自于石油外,还有HCl。现有1t石油,试计算可得出多少吨聚乙烯和聚氯乙烯(理论上假设石油的全部成分为碳和氢,并且在生产聚乙烯、聚氯乙烯的过程中没有碳原子和氢原子的损失)
。
(3)试根据上述信息及计算结果,谈谈该如何对待聚氯乙烯的使用。
21.(7分)NaHCO3和KHCO3的混合物9.20g和100mL 盐酸反应。
⑴若NaHCO3和KHCO3的物质的量相同,
①试分析,欲求标准状况下生成CO2的体积时,还需什么数据(用a、b等表示,要注明)。答: ;
②求标准状况下生成CO2的体积:
|
所需数据的取值范围 |
生成CO2的体积(标准状况) |
|
盐酸不足时: |
|
|
盐酸过量时: |
|
⑵ 若NaHCO3和KHCO3不是等物质的量混合,则9.20g固体与足量盐酸完全反应时,在标准状况下生成CO2的体积大于 L;小于 L。
20.(10分)计算以下两小题时,除必须应用所有给出的数据外,还各缺少一个数据,指出该数据的名称(分别以a和b表示),并列出计算式。
(1)在温度为t℃和压力为pPa的情况下,19.5g A 与11.0g B恰好完全反应,生成固体C和3.00L的D气体,计算生成的C的质量(m)。
缺少的数据是:
计算式为m=
(2)0.48g金属镁与10mL盐酸反应,计算生成的H2在标准状况下的体积(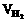 )
)
缺少的数据是:
计算式为:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com