
题目列表(包括答案和解析)
2.下列离子不能被氧化的是 ( )
A. Br- B.I- C.SO42- D.S2-
1.下列叙述中正确的是 ( )
A.元素的单质可由氧化含该元素的化合物来制得
B.失电子越多的还原剂,其还原性就越强
C.阳离子只能得电子被还原,作氧化剂
D.含有最高价元素的化合物一定具有强氧化性
25.已知NaCl在60 ℃时的溶解度是37.1 g。现电解60 ℃的经净化的饱和食盐水685.5 g,电解一段时间后得到密度为1.37 g/mL的溶液630 g。
⑴两电极上的反应:
阳极: ,阴极: 。
⑵电解后NaCl在溶液的物质的量浓度 。
24.蓄电池使用日久后,正负极标志模糊,现根据下列两条件,如何来判断正负极:
(1)氯化铜溶液,两根带有铜导线的碳棒 ;
(2)硫酸铜溶液,两根铜导线 。
23.在一小张刚浸过KMnO4溶液的滤纸上分别有A、B两铜片通过导线连接电源的两极,在铜片间的滤纸上滴一滴溶液,通电一段时间后,发现A、B间紫红色圆点向A极移动了一段距离,则与A相连的是电源的 极,可发现滤纸的 极边沿附近有 色出现。
22.从H+、Na+、Cu2+、Cl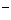 、SO
、SO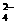 五种离子中选恰当的组成构成电解质,按下列要求进行电解:
五种离子中选恰当的组成构成电解质,按下列要求进行电解:
⑴以碳棒为电极,使电解质质量减小,水量不变进行电解,应采用的电解质是 ;
⑵以碳棒为电极,使电解质质量不变,水量减小进行电解,应采用的电解质是 ;
⑶以碳棒为阳极,铁棒为阴极,使电解质质量和水量都减小进行电解,应采用的电解质是 。
21.某种氯化镁晶体由Mg2+、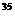 Cl
Cl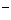 、
、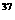 Cl
Cl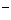 三种离子组成,在熔融条件下使1mol这种氯化镁完全电解,测得产生的气体是相同条件下相同体积氧气质量的2.22倍,则这种氯化镁中
三种离子组成,在熔融条件下使1mol这种氯化镁完全电解,测得产生的气体是相同条件下相同体积氧气质量的2.22倍,则这种氯化镁中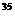 Cl
Cl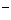 占总氯离子约为 %。
占总氯离子约为 %。
20.用一张滤纸浸湿些食盐水和酚酞试剂,放在表面皿上,滤纸两端用电极与直流电源相连,过一会发现其中一根导线连接的电极所接触的滤纸附近出现红色。简述出现红色的原因并指出该导线是直流电源的哪一极。答: 。
19.把由A、B、C三种金属组成的合金,暴露在潮湿的空气中,发现覆盖在合金表面液层中有B离子。如果把这合金作为电解槽的阴极,含A阳离子的盐配成电解质溶液,通电后,A、B、C都以离子形式进入电解液,但在阴极只有A析出。则三种金属的活动性由弱到强的是 。
18.要在塑料制品上镀铜,应先除去塑料制品表面的油和杂质,再沉淀一层导电的金属膜,然后把它作 极,用 作电镀液。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com