
题目列表(包括答案和解析)
30.(5分)试样X由氧化亚铁和氧化铜组成,取质量相等的两份试样按下图进行实验:
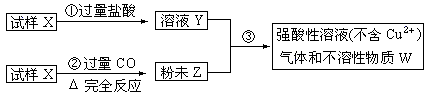
(1)请写出步聚③中发生的全部反应的离子方程式: [答:Cu2++Fe == Cu+Fe2+ 2H++Fe == H2+Fe2+]
(2)若全部的溶液Y和全部的粉未Z充分反应,生成的不溶物W的质量是m,则每份试样X中氧化铜的质量为(用m表示):
[答:0.625m(或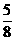 m)]
m)]
29.(5分)(1)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式:[答:2HSO4-+Ba2++2OH- == 2H2O+BaSO4¯+SO42-或2H++SO42-+Ba2++2OH- == 2H2O+BaSO4¯] (2)在以上中性溶液中,继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式:
[答: SO42-+Ba2+ == H2O+BaSO4¯]
28.(10分)1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度是2.18克/厘米3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验中可以用下图所示装置制备1,2-二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有浓溴(表面覆盖少量水)。
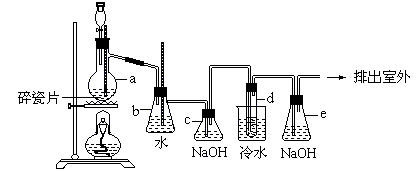
填写下列空白: (1)写出本题中制备1,2-二溴乙烷的两个化学方程式
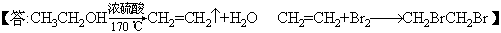 (2)安全瓶b可以以上倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象。
[答:b中水面会下降,玻璃管中的水面会上升,甚至溢出]
(3)容器c中NaOH溶液的作用是:
[答:除去乙 烯中带出的酸性气体或答二氧化碳、二氧化硫]
(4)某学生做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超出许多,如果装置的气密性没有问题,试分析其可能的原因。
[答:①乙烯发生(或通过液溴)速度过快 ②实验过程中,乙烯和浓硫酸的混合液没有迅速达到170℃(或写“控温不当”也可以)]
(2)安全瓶b可以以上倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象。
[答:b中水面会下降,玻璃管中的水面会上升,甚至溢出]
(3)容器c中NaOH溶液的作用是:
[答:除去乙 烯中带出的酸性气体或答二氧化碳、二氧化硫]
(4)某学生做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超出许多,如果装置的气密性没有问题,试分析其可能的原因。
[答:①乙烯发生(或通过液溴)速度过快 ②实验过程中,乙烯和浓硫酸的混合液没有迅速达到170℃(或写“控温不当”也可以)]
27.(4分)进行化学实验必须注意安全,下列说法正确的是(填写标号) [答:A、B、C] A.不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 B.不慎将浓碱沾到皮肤上,应立即用大量水冲洗,然后涂上硼酸溶液 C.如果苯酚浓溶液沾到皮肤上,应立即用酒精洗 D.配制浓硫酸时,可先在量筒中加一定体积的水,再在搅拌下慢慢加入浓硫酸
26.一定量的乙醇在氧气不足的情况下燃烧,得到CO、CO2和水的总质量为27.6克,若其中水的质量为10.8克,则CO的质量是--------------------------------( A ) A.1.4克 B.2.2克 C.4.4克 D.在2.2克和4.4克之间
[提示]:设一氧化碳的物质的量为x,二氧化碳的物质的量为y
由产物中碳的氧化物的质量和可得:28x+44y = 27.6-10.8
再根据碳原子守恒可得:x+y = 0.2×2 解得:x=0.05(摩),故CO的质量=1.4克
25.X、Y、Z和R分别代表四种元素。如果aXm+、bYn+、cZn-、dRm-四种离子的电子层结构相同(a、b、c、d为元素的原子序数),则下列关系正确的是----------------------------------------------------------------------------------------------------( D ) A.a-c=m-n B.a-b=n-m C.c-d=m+n D.b-d=n+m
24.某金属单质跟一定浓度的硝酸反应,假定只产生单一的还原产物。当参加反应的单质与被还原硝酸的物质的量之比为2:1时,还原产物是----------------( C ) A.NO2 B.NO C.N2O D.N2
[提示]:根据电子得失守恒可知:
2R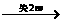 2R(NO3)n(R表示金属元素)
HNO3
2R(NO3)n(R表示金属元素)
HNO3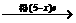
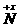 (n表示R的化合价)
即2ne=(5-x)e(x表示还原产物N化合价)
当n=1时,x =3,无答案(N2O3) 当n=2,=+1,答案为C
(n表示R的化合价)
即2ne=(5-x)e(x表示还原产物N化合价)
当n=1时,x =3,无答案(N2O3) 当n=2,=+1,答案为C
23.若室温时PH=a的氨水与PH=b的盐酸等体积混和,恰好完全反应,则该氨水的电离可表示为-------------------------------------------------------------------------( A ) A.10(a+b-12)% B.10(a+b-14)% C.10(12-a-b)% D.10(14-a-b)%
22.密度为0.91克/厘米3的氨水,质量百分比浓度为25%(即质量分数为0.25),该氨水用等体积的水稀释后,所得溶液的质量百分比浓度为---------------------( C ) A.等于12.5% B.大于12.5% C.小于12.5% D.无法确定
[提示]:设氨水和水的体积各V毫升,用水稀释后的氨水的质量百分比浓度为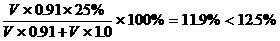
21.为实现我国2000年消除碘缺乏病的目标,卫生部规定食盐必须加碘,其中的碘以碘酸钾(KIO3)形式存在。已知溶液中IO3-可以与I-发生如下的反应: IO3-+5 I-+6H+ == 3I2+3H2O 据此反应,可用试剂和一些生活中常见的物质进行试验,证明在食盐在存在着IO3-。可供选用的物质是:①自来水 ②蓝色石蕊试纸 ③碘化钾淀粉试纸 ④淀粉 ⑤食糖 ⑥食醋 ⑦白酒。进行上叙实验时必须使用的物质是-------------------( B ) A.①③ B.③⑥ C.②④⑥ D.①②④⑤⑦
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com