
题目列表(包括答案和解析)
5、实验室测量食盐中KI含量,常在一定条件下用过量溴水使KI变成碘,用煮沸法除去过量的溴避免干扰,再利用反应2Na2S2O3+I2=Na2S4O6+2NaI来分析碘的含量试回答:
(1)滴定时,选用的指示剂是( )
A、石蕊 B、酚酞 C、甲基橙 D、淀粉液
(2)假若溴大大过量时,宜用除去溴的正确方法是( )
A、加入过量AgNO3溶液 B、加入苯酚
C、加入足量KI D、加入溴化钾
4、
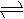 氯水不稳定,因为氯水中存在如下平衡:Cl2+H2O HCl+HClO,为了提高氯水的
氯水不稳定,因为氯水中存在如下平衡:Cl2+H2O HCl+HClO,为了提高氯水的
稳定性,可采取的措施是( )
A、通入少量H2S气体 B、加入少量小苏打
C、通入少量HCl气体 D、增大氯水浓度
3、 关于氯气和SO2性质的叙述正确的是( )
A、在相同条件下,Cl2 比SO2更易溶于水
B、 常温下等体积的Cl2和SO2混合气体通入BaCl2溶液时无明显现象
C、 Cl2和SO2分别通入H2S溶液中都可变浑浊
D、等体积的Cl2和SO2分别通入石蕊试液中,溶液的紫色立即褪去
2、 在一支试管中盛有某种固体物质,加适量溴水后,溶液颜色不会褪去的是( )
A、KOH B、KI C、Na2SO3 D、FeCl2
1、 下列关于氯及其化合物的叙述中正确的是( )
A、因为氯气有毒,有强氧化性,所以氯气可用于杀菌、消毒、漂白.
B、 常温下1体积水中能溶解2体积Cl2,所以饱和氯水是浓溶液.
C、 氯气跟碱溶液的反应实质是Cl2和H2O的反应.
D、在使用漂白粉时,加入醋酸可增强漂白作用.
(二)化学性质
由于最外层均为7个电子,极易得一个电子,因此卤素都是强氧化剂,在自然界均只以化合态存在.但随着电子层数递增,原子半径渐增大,核对外层电子的引力渐减弱,得电子能力渐减弱,其氧化性逐渐减弱,主要表现:
1、 都能与金属反应
①F2和所有金属都能反应.
②Cl2和绝大多数金属反应.
③Br2和较活泼金属反应.
④I2只和活泼金属反应.
2、 都能与H2、P等非金属反应.
①F2和H2在暗处即爆炸(F2是非金属性最强的元素)
②Cl2和H2需光照爆炸
③Br2和H2需加热且缓慢化合(不爆炸)
④I2(蒸气)和H2持续加热且仍为可逆反应.
3、特性:
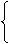 易升华
易升华
① I2 ②溴--唯一的常温呈液态的非金属,易挥发保存时加水封.
使淀粉变蓝色
③ F2--最强氧化剂,不能用氧化剂将F-氧化为F2(只能用电解法)F元素无正价.
且能与稀有气体化合.
 ④卤化氢--均易溶于水,在空气中形成白雾,其中只有HF剧毒,但HX都是大气污染物,水溶液均呈酸性,只有氢氟酸是弱酸,从HF HI,酸性逐渐增强.
④卤化氢--均易溶于水,在空气中形成白雾,其中只有HF剧毒,但HX都是大气污染物,水溶液均呈酸性,只有氢氟酸是弱酸,从HF HI,酸性逐渐增强.
⑤NaX--只有NaF有毒可用作农药.
⑥CaX2--只有CaF2不溶于水,CaCl2作干燥剂.
⑦AgX--只有AgF可溶,AgX均具感光性,AgBr作感光材料,AgI作人工降雨材料.
HClO、HClO2、HClO3、HClO4
 ⑧
⑧
酸性逐渐增强,氧化性逐渐减弱
[能力训练]
(一)卤素的原子结构和单质的物理性质
随卤素核电荷数增加,电子层数依次递增,原子半径渐增大,其原子结构的递变而使卤素单质的物理性质呈规律性变化.
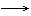 从F2 I2
从F2 I2
1、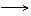
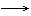
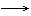
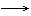
 颜色渐加深,状态从气 液 固,密度从小 大,熔沸点由低 高(分子晶体)
颜色渐加深,状态从气 液 固,密度从小 大,熔沸点由低 高(分子晶体)
2、单质的溶解性--除氟外(与水剧烈反应)在水中溶解度都较小,且由大 小,都易溶于有机溶剂,下表列出Cl2、Br2、I2在不同溶剂中的颜色.
|
|
水 |
CCl4 |
汽油(苯) |
|
Cl2 |
黄绿色 |
黄绿色 |
黄绿色 |
|
Br2 |
橙色 |
橙红色 |
橙红色 |
|
I2 |
棕黄色 |
紫色 |
紫红色 |
(二)化学性质(以HCl为例)
HCl为共价化合物,液态不导电,因此不能表现出酸的通性!一般不能与金属反应.
NH3+HCl=NH4Cl(白烟)互相检验
与有机物发生加成反应--制取卤代烃.
思考:制取卤代烃途径有几条?其中最佳途径是什么?
(一是烷烃与卤素单质取代一般不能用来制卤代烃,实验室条件无法分离.二是氢卤酸与醇的取代,三是不饱和烃和卤素或卤化氢加成,这是制卤代烃的最佳途径)
(一)制法 1、原理--不挥发性酸制挥发性酸.
(1)HCl: NaCl+H2SO4(浓)=NaHSO4+HCl↑(不加热或微热)
 2NaCl+H2SO4(浓) △ Na2SO4+2HCl↑(加强热)
2NaCl+H2SO4(浓) △ Na2SO4+2HCl↑(加强热)
思考:①不加热也能制得HCl,为何通常是在加热条件下制取HCl?
(主要是提高成本较高的H2SO4的利用率)
②若浓H2SO4过量,在强热条件下,产物是Na2SO4还是NaHSO4?
(NaHSO4)
③先加热还是先往烧瓶中加入浓H2SO4再加热?为什么?
(先加入浓H2SO4,再加热否则冷的浓H2SO4加入到热烧瓶中,易使烧瓶破裂)
④其它金属氯化物与浓H2SO4反应能否制得HCl?为何一般只用NaCl?
(能,如 KCl+H2SO4(浓)--, AlCl3+H2SO4(浓)--, MgCl2(浓)+H2SO4(浓)-,因NaCl成本最低)
⑤如何快速制取HCl气体?
(往浓HCl中入浓H2SO4或浓盐酸加入到P2O5固体中)
(2)HF--浓H2SO4和CaF2(萤石)在铅皿中制取
 (3)HBr--浓H3PO4和NaBr反应 NaBr+H3PO4(浓) △ NaH2PO4+HBr↑
(3)HBr--浓H3PO4和NaBr反应 NaBr+H3PO4(浓) △ NaH2PO4+HBr↑
 向上排空气法
向上排空气法
2、 收集方法 验满:①观察法(白雾)
②湿蓝石蕊试纸
③浓氨水
3、 吸收装置
 Cl2、H2S、SO2、NO2等一般用NaOH才能完全吸收(H2S还可用CuSO4
Cl2、H2S、SO2、NO2等一般用NaOH才能完全吸收(H2S还可用CuSO4
溶液)
(1) 吸收剂 CO、NO只能用气球收集尾气
HCl用水即可
(2) 装置--水面上倒扣一只漏斗.
4、氯气制法
(1)反应原理(尽可能考虑能够生成氯气的途径)
 MnO2+4HCl(浓)△ MnCl2+Cl2↑+2H2O--实验室通常用该法制Cl2
MnO2+4HCl(浓)△ MnCl2+Cl2↑+2H2O--实验室通常用该法制Cl2
在这个反应中①盐酸作用?(还原剂与酸)②足量MnO2和含4mol HCl的浓盐酸加热制得Cl2物质的量 1mol(填小于或等于或大于)(小于)
③该反应必须加热到900C左右,为什么温度不能再高?(盐酸是挥发性酸,温度再高Cl2中HCl含量高)
④若实验室没有浓盐酸,可用什么代替?写出化学方程式.
 (NaCl固体和浓H2SO4,2NaCl+MnO2+2H2SO4 △ MnSO4+Cl2↑+2H2O,亦可用NaCl和NaHSO4固体代替)
(NaCl固体和浓H2SO4,2NaCl+MnO2+2H2SO4 △ MnSO4+Cl2↑+2H2O,亦可用NaCl和NaHSO4固体代替)
⑤其它可能生成Cl2途径有:
 KMnO4+HCl(浓)--
KClO3+HCl(浓) △
KMnO4+HCl(浓)--
KClO3+HCl(浓) △
K2Cr2O7+HCl(浓)-- PbO2+HCl(浓)--
 Ca(ClO)2+HCl(浓)-- NaCl+H2O
电解 (工业制 Cl2)
Ca(ClO)2+HCl(浓)-- NaCl+H2O
电解 (工业制 Cl2)
 ⑥历史上曾用地康法制Cl2 HCl(气)+O2
⑥历史上曾用地康法制Cl2 HCl(气)+O2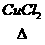 Cl2+H2O试根据以上反应比较KMnO4、MnO2、O2三种物质的氧化性强弱(氧化性KMnO4>MnO2>O2)
Cl2+H2O试根据以上反应比较KMnO4、MnO2、O2三种物质的氧化性强弱(氧化性KMnO4>MnO2>O2)
(2)发生装置除用来制Cl2还可用来制取哪些气体?
(HCl、SO2、CO、NO等)
(3)除杂装置(洗气)--除去Cl2中少量HCl、水蒸气,可先通入饱和食盐水(亦可用水)除去HCl,再通过浓H2SO4(或P2O5或CaCl2)除去水.
 用向上排空气法
用向上排空气法
(4)收集装置 验满: ①观察法(黄绿色)
②湿淀粉--KI试纸(或品红试纸)
③湿石蕊试纸
④浓NH3水, 3Cl2+8NH3=6NH4Cl+N2
(5)吸收装置--烧杯中盛有NaOH溶液(不能用水代替)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com