
题目列表(包括答案和解析)
4、下列说法正确的是(NA为阿伏加德罗常数)( )
A.124 g P4含有p-P键的个数为4NA B.12 g石墨中含有C-C键的个数为1.5NA
C.12 g金刚石中含有C-C键的个数为4NA D.60gSi02中含Si-O键的个数为2NA
3、下列物质的熔、沸点高低顺序正确的是 ( )
A.金刚石>晶体硅>二氧化硅>碳化硅 B.Cl4>CBr4>CCl4>CH4
C.MgO>H20>02>N2 >H20 D.金刚石>生铁>纯铁>钠
2、含有非极性键的离子化合物是 ( )
A.C2H2 B.Na2O2 C.(NH4)2S D.CaCl2
1、 “绿色化学”(Green Chemistry)的目标是研究和寻找能充分利用的无毒害原料,最大限度地节约能源,在化工生产各个环节都实现净化和无污染的反应途径。下列各项属于“绿色化学”的是( )
A.处理废弃物 B.治理污染点 C.减少有毒物质 D.杜绝污染源
36.(12分)1996年诺贝尔化学奖授予对发现C60有重大贡献的三位科学家。C60分子是形如球状的多面体(如图),该结构的建立基于以下的考虑:
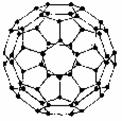
①C60分子中每个碳原子只跟相邻的3个碳原子形成化学键
②C60分子只含有五边形和六边形
③多面体的顶点数、面数和棱这数的关系,遵循欧拉定理:
顶点数 + 面数-棱边数 = 2
据上所述,可推知C60分子有12个五边形和20个六边形, C60分子所含的双键数为30。
请回答下列问题:
(1)固体C60与金刚石相比较,熔点较高者应是[答:金刚石],理由是[答:金刚石的晶体类型是原子晶体,而固体C60不属于原子晶体(实际上可以认为是分子晶体)]
(2)试估计C60跟F2在一定条件下能否发生反应生成C60F 60(填“可能”或“不可能”)[答:可能],并简述其理由[答:因C60分子中含有30个双键,与极活泼的F2发生加成反应可能生成C60F60]
(3)通过计算,确定C60分子所含单键数。
[解]:由欧拉定理计算键数为60+(12+20)-2=90,则分子中的单键数=90-30=60
(4) C70分子也已经制得,它的分子结构模型可以与C60同样考虑面推知。通过计算确定C70分子中五边形和六边形的数目。
[解]:设C70分子中的五边形的数目为x个,六边形的数目为y个,由题意可得方程组:
 解得五边形的数目x=12,六边形的数目y=25
解得五边形的数目x=12,六边形的数目y=25
35.(6分)将8.8克FeS固体置于200毫升2.0摩/升的盐酸中,以制备H2S气体。反应完全后,若溶液中H2S的浓度为0.10摩/升,假定溶液体积不变,试计算: (1)收集到的H2S气体的体积(标准状况)。 (2)溶液中Fe2+和H+的物质量浓度(摩尔浓度)
[提示]:根据方程式FeS+2H+
= Fe2++H2S可判断盐酸过量,计算以FeS的物质的量为基准。FeS的物质的量=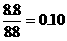 摩尔
(1)共生成H2S0.10摩尔,在溶液中溶解的物质的量为0.10×0.20=0.02摩尔,所以收集到H2S气体的物质的量=0.10-0.02=0.08摩尔,换算成体积=22.4×0.08=1.8升。
(2)生成Fe2+0.10摩尔,其浓度为
摩尔
(1)共生成H2S0.10摩尔,在溶液中溶解的物质的量为0.10×0.20=0.02摩尔,所以收集到H2S气体的物质的量=0.10-0.02=0.08摩尔,换算成体积=22.4×0.08=1.8升。
(2)生成Fe2+0.10摩尔,其浓度为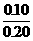 =0.5摩/升,消耗掉H+的物质的量为0.20摩尔。反应前H+的物质的量为2.0×0.2=0.4摩尔,故H+最后的浓度为
=0.5摩/升,消耗掉H+的物质的量为0.20摩尔。反应前H+的物质的量为2.0×0.2=0.4摩尔,故H+最后的浓度为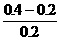 =1.0摩/升。
=1.0摩/升。
34.(7分)A、B都是芳香族化合物,1摩尔A水解得到1摩尔B和1摩尔醋酸。A、B的分子量都不超过200,完全燃烧都只生成CO2和H2O,且B分子中碳和氢元素总的质量百分含量为65.2%(即质量分数为0.652)。A的溶液具有酸性,不能使FeCl3溶液显色。
(1)A、B的分子量之差为[答:42]
(2)1个B分子中应该有[答:3]个氧原子
(3)A的分子式是[答:C9H8O4]
(4)B可能的三种结构简式是
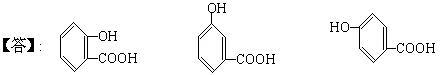 [提示]:A+H2O
® CH3COOH+B,设MA、MB分别为A、B的分子量,MA+18=60+MB,MA-MB=42,所以A、B分子量之差为42,B分子量不超过200-42=158,A显酸性,不能使FeCl3溶液显色,说明有羧基,因此B也有羧基,且有从A(醋酸酯)水解产生的羟基,推测B可能有3个氧原子。由题意B可能的分子量MB=
[提示]:A+H2O
® CH3COOH+B,设MA、MB分别为A、B的分子量,MA+18=60+MB,MA-MB=42,所以A、B分子量之差为42,B分子量不超过200-42=158,A显酸性,不能使FeCl3溶液显色,说明有羧基,因此B也有羧基,且有从A(醋酸酯)水解产生的羟基,推测B可能有3个氧原子。由题意B可能的分子量MB=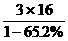 =138<158合理,由分子量为138且含有羧基和羟基,推得B为羟基苯甲酸。
=138<158合理,由分子量为138且含有羧基和羟基,推得B为羟基苯甲酸。
33.(6分)通常情况下,多个羟基连在同一个碳原子上的分子结构是不稳定的,容易自动失水,生成碳氧双键的结构:
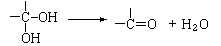 下面是9个化合物的转变关系:
下面是9个化合物的转变关系:
 (1)化合物①是[答:甲苯],它跟氯气发生反应的条件A是[答:光照]
(2)化合物⑤跟⑦可在酸的催化下去水生成化合物⑨, ⑨的结构简式是:[答:略]名称是[答:苯甲酸苯甲酯(或苯甲酸苄酯)]
(3)化合物⑨是重要的定香剂,香料工业上常用化合物⑧和②直接合成它。此反应的化学方程式是
(1)化合物①是[答:甲苯],它跟氯气发生反应的条件A是[答:光照]
(2)化合物⑤跟⑦可在酸的催化下去水生成化合物⑨, ⑨的结构简式是:[答:略]名称是[答:苯甲酸苯甲酯(或苯甲酸苄酯)]
(3)化合物⑨是重要的定香剂,香料工业上常用化合物⑧和②直接合成它。此反应的化学方程式是
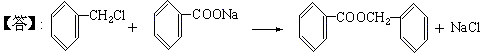
32.(4分)有机化学中取代反应的范畴很广。下列6个反应中,属于取代反应范畴的是(填写相应的字母):[答:A、C、E、F]
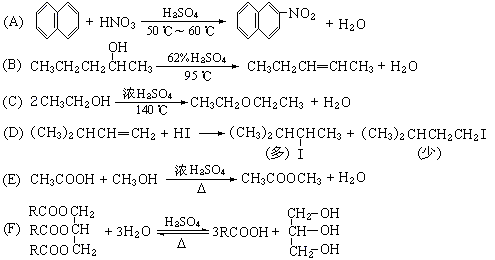
(式中R是正十七烷基CH3(CH2)15CH2-)
31.(7分)某无色溶液可能含有下列钠盐中的几种:(A)氯化钠(B)硫化钠(C)亚硫酸钠(D)硫代硫酸钠(E)硫酸钠(F)碳酸钠。向此溶液中加入适量稀硫酸,有浅黄色沉淀析出,同时有气体产生。此气体有臭鸡蛋气味,可使澄清的石灰水变浑浊,不能使品红试液褪色。根据上述实验现象回答下列问题:
(1)不能使品红试液褪色,说明该气体中不含[答:SO2](填分子式)。
(2)此无色溶液至少存在哪几种盐?请写出全部可能的情况(填写相应的字母):
第一种情况是:[答:B、C、F]
第二种情况是:[答:B、D、F]
第三种情况是:
第四种情况是:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com