
题目列表(包括答案和解析)
1. 当前,我国环境保护急待解决的白色污染问题指的是 ( )
A 白色建筑废料 B 纸张的大量浪费
C 粮食产品大量使用的漂白剂 D 塑料制品废弃物
3. [Fe(SO4)3]=0.25mol/L
[CuSO4]=2.45mol/L
1. D 2. B 3. D 4.A 5. C
3、在500mlCuSO4和Fe2(SO4)3的混合物中加入21.7g铁粉,充分搅拌,待完全反应后滤出残留物,称其质量为16.8g。在滤液中加4mol/LBaCl2溶液400ml,恰好使SO42-完全沉淀。求原溶液中CuSO4和Fe2(SO4)3物质的量浓度。
[能力训练答案]
2、1.92g铜和一定量的浓HNO3反应,随着铜的不断减少,反应生成的气体颜色也逐渐变浅,当铜反应完毕时,共收集到气体的体积为1.12L(标况),求反应中消耗硝酸的物质的量是多少?
1、18.4gNaOH和NaHCO3固体混合物,在密闭容器中加热到250℃,以充分反应后排出气体,称得剩余固体质量为16.6g,计算原混和物中NaOH的质量分数。
(一) 选择题(每小题有1-2个正确答案)



 1、在温度和压强不变时,1L
NO2高温分解,按2NO2 2NO+O2进行,达到平衡时气体体积变为1.2L,则NO2的分解率为( )
1、在温度和压强不变时,1L
NO2高温分解,按2NO2 2NO+O2进行,达到平衡时气体体积变为1.2L,则NO2的分解率为( )
A.20% B.30% C.50% D.40%
2、把氯气和氮气混合气1.12L(90%Cl2和10%N2)通过浓氨水,实验测得逸出的气体(除NH3)体积为0.672L(50%Cl2和50%N2),问反应后被氧化的氨的质量是(体积已换算成标况)( )
A. 3.4g B. 0.34g C. 1.36g D. 13.6g
3、在N2和H2合成氨反应中,达到平衡时氨占26%,则反应后气体体积缩小的百分率为( )
A. 52% B. 30% C. 26% D. 20.6%
4、有一在空气中暴露过KOH的固体,经分析知其含水7.65%,含K2CO34.32%,其余是KOH。若将ag样品放入bml 1mol/L的盐酸中,使其充分作用后,残酸用25.52ml cmol/l的KOH溶液恰好中和。蒸发所得溶液,得到固体质量的表达式中(单位为克)( )
A. 只含有b B. 应含有a C. 必有c D. 一定有a、b、c
5、在一包质量为8.2g由两种碳酸盐组成的混合物,加入足量稀盐酸,并微热之,若放出CO2气体4.4g,则下列哪种组合是可能的( )
A. NaHCO3与MgCO3 B. CaCO3 与Na2CO3
C. Ca(HCO3)2与MgCO3 D. Na2CO3与NaHCO3
1、差量法:差量法适用于反应前后质量、物质的量、体积等变化。
例1:取Na2CO3和NaHCO3混合物9.5g先配成稀溶液,然后向该溶液中加入9.6g碱石灰,充分反应后Ca2+、HCO3-、CO32-恰好转化为沉淀,再将反应器内水蒸干,可得20g白色固体,求:(1)原混合物中Na2CO3和NaHCO3质量;
(2)碱石灰中CaO和NaOH质量。
解析:该题一般解法设Na2CO3、NaHCO3物质的量为x、y立方程组(根据恰好沉淀),但费时。若仔细分析提供的数据以及反应原理,应用质量差计算更方便:加入物质共9.5g+9.6g=19.1g,生成固体20g,增加20g–19.1g=0.9g,这是什么原因?
CaO+H2O=Ca(OH)2 ①每有1molCaO吸收1mol水,质量增加18g而反应
Ca(OH)2+NaHCO3=CaCO3↓+NaOH+H2O ②又生成1mol水,即反应①②前后质量不变,但
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH ③即反应①③要引起所加固体质量增加,即增加水的物质的量为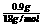 =0.05mol
=0.05mol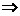
 =0.05mol
=0.05mol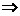
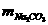 =5.3g
=5.3g
 =4.2g。
=4.2g。
例2:某丁烷和乙炔的混合物0.1mol与20LO2(标况,O2过量)完全反应,将所得混合物通入足量Na2O2固体粉末中,使之完全反应,得标况下气体17.2L。通过计算确定原混合气体中各烃为多少克?
解析:烃在氧气中燃烧生成CO2和水,需消耗一定量氧气,而CO2和H2O与Na2O2反应又能生成O2,两者之差即为反应中减少的氧气。解题过程为:
C4H10+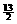 O2→4CO2+5H2O …… ①
O2→4CO2+5H2O …… ①
4CO2+4Na2O2=4Na2CO3+2O2 …… ②
5H2O+5Na2O2=10NaOH+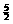 O2 …… ③
O2 …… ③
①②③迭加得:C4H10+9Na2O2+2O2=4Na2CO3+10NaOH …… ④
在反应④中,1molC4H10,实际消耗2molO2
同理:C2H2+3Na2O2+O2=2Na2CO3+2NaOH
设C4H10、C2H2物质的量分别为x、y
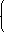 x+y=0.1mol
x+y=0.1mol
2x+y=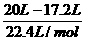
x=0.025mol
y=0.075mol
2、讨论法:
例:将H2S和O2和混合气体通入温度为220℃的密闭容器中,在高温下使之燃烧,反应后再恢复至原温度测得此时容器中气体的压强比起始时减小28.6%。
问(1)在容器中H2S发生的是完全燃烧不是不完全燃烧?
(2)原混和气体中H2S所占的体积分数?
解析:首先应明确,同温同体积任何气体的压强比等于物质的量之比。显然,压强减小28.6%即物质的量减小28.6%。接下来就要根据物质的量减小28.6%讨论是完全燃烧还是不完全燃烧。解题过程为:

 若H2S完全燃烧: 2H2S + 3O2 点燃 2SO2+2H2O Δn(减小) n%
若H2S完全燃烧: 2H2S + 3O2 点燃 2SO2+2H2O Δn(减小) n%
2mol 3mol 2mol 2mol 1mol 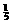 ×100%=20%
×100%=20%
显然不等于28.6%,肯定为不完全燃烧,而
2H2S + O2 = 2S + 2H2O Δn(减小) n%
2mol 1mol 2mol 1mol 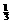 ×100%=33.3%
×100%=33.3%
28.6%介于20%与33.3%之间应有两种情况。
①H2S过量。设H2S、O2物质的量分别为x、y。
2H2S + O2 = 2S + 2H2O Δn
2 1 2 1
ymol ymol
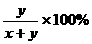 =28.6% y=0.400x
=28.6% y=0.400x
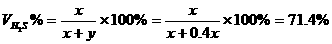
②H2S与O2均消耗完全,但产物为S、SO2和H2O,设H2S、O2物质的量分别为x、y,可将 x、y直接代入化学方程式中:
xH2S+yO2=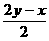 SO2+
SO2+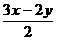 S+xH2O
Δn
S+xH2O
Δn
x y 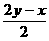 x
x 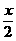
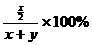 =28.6%
y=0.748x
=28.6%
y=0.748x

3.守恒法--上一讲已介绍。
4.极限法。
例:在500ml含有Fe3+ 、cu2+的溶液中投入11g铁粉,反应完全后过滤,所得固体物质经干燥后称重为9g。滤液中的金属离子用0.3mol OH-恰好使它们完全沉淀。试求原溶液中Fe3+ 、Cu2+的物质的量浓度。
解析:本题的难点在于11g铁粉是否过量不清楚,但同学们必须明确:由于有剩余固体,则Fe3+ 全部转化为Fe2+,也就是说0.3mol OH-使金属离子完全沉淀,这些金属离子必为+2价(不是Fe2+ 就是Fe2+ 和Cu2+混合物)。由此得出:n金属离子=0.15mol。现在的问题是如何判断溶液中是Fe2+还是Fe2+ 和Cu2+混合物(即铁粉是否过量)?可用极限法。
解:设铁粉过量,则0.15mol为Fe2+,且这些Fe2+全部由Fe3+产生或全部由cu2+产生,它们分别消耗铁的质量为:
2Fe3+ + Fe = 3Fe2+
56g 3mol
2.8g 0.15mol
Cu2+ + Fe = Fe2+ + Cu
56g 1mol
8.4g 0.15mol
则铁粉一定过量(11g大于2.8g或8.4g)
设Fe3+ 、Cu2+物质的量分别为x、y
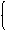 1.5x+y=0.15
1.5x+y=0.15
28x–8y=2
x=0.08mol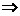 0.16mol/L
0.16mol/L
y=0.03mol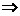 0.06mol/L
0.06mol/L
从本题的解题过程看出:解题方法不是固定的,同一道题多种解法综合运用。
[能力训练]
0.15mol 0.15mol 0.15mol
设氧化铁物质的量为X,则与之反应的Fe物质的量亦为X。
因:Fe+Fe2O3+3H2SO4=3FeSO4+3H2O
则:160g/mol·x+(0.15+x)×56g/mol=19.2g
x=0.05mol
加入Fe2O3质量:0.05mol×160g/mol=8g
加入Fe粉的质量:19.2g–8g=11.2g
(2)产生H2消耗H2SO40.15mol,Fe 和Fe2O3反应中消耗硫酸0.05mol×3=0.15mol,由于题目中并未指出H2SO4恰好反应(强调认真审题),因此
 ≥0.15mol+0.15mol=0.3mol
≥0.15mol+0.15mol=0.3mol
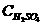 ≥
≥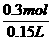 =2mol/L
=2mol/L
答:加入的Fe2O3为8g铁粉为11.2g,稀H2SO4物质的量浓度≥2mol/L。

 1、认真审题:根据题意,写出正确的化学反应方程式或离子反应方程式或正确的关系式。这一点是有关化学方程式计算的前提。例如涉及H2S气体燃烧的有关计算首先要分析可能发生的化学方程式(O2不足,H2S过量:2H2S+O2 点燃 2S+2H2O;O2充足即过量,
1、认真审题:根据题意,写出正确的化学反应方程式或离子反应方程式或正确的关系式。这一点是有关化学方程式计算的前提。例如涉及H2S气体燃烧的有关计算首先要分析可能发生的化学方程式(O2不足,H2S过量:2H2S+O2 点燃 2S+2H2O;O2充足即过量,

 2H2S+3O2 点燃 2SO2+2H2O;两种反应物均耗尽,但产物中既有S又有SO2。);第二,看清题目中已知什么,需要求的是什么。例如求转化率(指反应物)还是产率(生成物)。题目提供的条件是否非常明了,有无隐含条件,根据化学原理直接导出,还是要根据数学、物理、化学知识推导而出等。
2H2S+3O2 点燃 2SO2+2H2O;两种反应物均耗尽,但产物中既有S又有SO2。);第二,看清题目中已知什么,需要求的是什么。例如求转化率(指反应物)还是产率(生成物)。题目提供的条件是否非常明了,有无隐含条件,根据化学原理直接导出,还是要根据数学、物理、化学知识推导而出等。
2、解题格式规范化。严格按照课本例题要求、解题过程规范、完整。计算过程必须带入单位。
例1:将Fe2O3溶于150ml的稀H2SO4中,待Fe2O3完全溶解后,再加入Fe粉,放出标准状况下气体3.36L,溶液中不再含有Fe和Fe3+。已知加入的铁粉和氧化铁共19.2g,计算:
(1)加入的Fe2O3和Fe各多少克?(2)稀H2SO4物质的量浓度。
解析:本题涉及的反应有三个Fe2O3+3H2SO4=Fe2(SO4)3+3H2O, Fe2(SO4)3+Fe=3FeSO4,
Fe+H2SO4=FeSO4+H2↑。由于溶液中不再含有Fe和Fe3+,显然,Fe除与H2SO4反应产生H2,余下Fe2O3和Fe物质的量必须相等。(相当于发生:Fe+Fe2O3+3H2SO4=3FeSO4+3H2O)。
正确解题过程为:
解:(1)由Fe + H2SO4= FeSO4 + H2↑
1mol 1mol 1mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com