
题目列表(包括答案和解析)
24、298K时,向VL真空容器内通入n mol SO2和m mol H2S。
⑴若n=2,则当m= 时,反应后容器内气体的密度最小;
⑵若2n>m,则反应后氧化产物与还原产物的质量差为 g;
⑶若5n=m,且反应后氧化产物与还原产物的质量和为48g,则n+m= 。
23、600K时,在容积可变的透明容器中,反应 2HI(g)≒I2(g)+H2(g) 达到平衡状态A。保持温度不变,将容器的容积压缩成为原容积的一半,达到平衡状态B。按图示的观察方向,能否看出两次平衡时容器内颜色深浅的变化?并请说明理由。

平衡状态A
平衡状态B
视线
22、298K时,合成氨反应的热化学方程式为
N2(g)+3H2(g) ≒ 2NH3(g)+92.4KJ
在该温度下,取1molN2和3molH2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量总是小于92.4KJ。其原因是
21、某固体混合物可能由KNO3、K2SO4、KI、KCL、NaCl、CuCl2、CaCl2和Na2CO3中的一种或几种组成。依次进行下列五步实验,观察到的现象记录如下:
⑴混合物加水得无色透明溶液;
⑵向上述溶液中滴加BaCl2溶液,有白色沉淀生成。将该沉淀滤出,并将滤液分成两份;
⑶上述白色沉淀可完全溶于稀盐酸;
⑷将两份滤液中的一份,滴加氯水并加入CCl4,振荡后静置,CCl4层无色;
⑸将另一份滤液中加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀硝酸。
根据以上实验,可以判断出混合物中肯定含有 ;但不能判断出是否含有 。
20、 有下列实验装置
有下列实验装置
示意图中A是简易的氢气发生器,B是大小适宜的圆底烧瓶,C是装有干燥剂的U形管,a是旋转活塞,D是装有还原铁粉的反应管,E是装有酚酞试液的试管。
实验前先检查实验装置的气密性。实验开始时,先关闭活塞a,并取下烧瓶B;向A中加入一定量浓度适当的盐酸,发生氢气,经必要的“操作”[见问题(2)]后,在导管的出口处点燃氢气,然后如图所示套上烧瓶B,塞紧瓶塞,氢气在烧瓶中继续燃烧。用酒精灯加热反应管D中的还原铁粉,待B中氢气的火焰熄灭后,打开活塞a,气体通过反应管D进入试管E中,使酚酞试液呈红色。请回答下列问题。
⑴实验前如何检查装置的气密性?
⑵点燃氢气闪必须进行 操作,进行该操作的方法是 。
⑶写出B、D中分别发生的化学反应方程式:
B中:
D中:
⑷C中所盛干燥剂的名称是 ;该干燥剂的作用是 。
19、在等物质的量的短周期金属元素单质A和B中,分别加入足量的酸,在A中加入盐酸,B中加入稀硫酸。反应完全后,生成氢气的体积分别为V(A)和V(B),而且V(A)≠V(B)。若要确定反应生成物中A和B的化合价,至少还需知道的数据是
A V(A):V(B)的值 B V(A)(或V(B))的值
C A(或B)的物质的量 D 盐酸和硫酸的物质的量浓度
第 Ⅱ 卷
(共四大题,8小题,60分)
18、在相同状况下的两杯甲酸溶液,第一杯甲酸溶液的浓度为c1,其电离度为α1;第二杯甲酸溶液的浓度为c2,其电离度为α2。若第二杯甲酸溶液中甲酸根离子的浓度恰为c1,则必然有
A 第一杯溶液的pH值大于第二杯溶液的pH值
B c1>c2 C α1<α2 C α1>α2
17、常温常压下,某容器真空的质量为201.0g,当它盛满甲烷时质量为203.4g,而盛满某气体Y时质量为205.5g,则Y气体可能是
A 氧气 B 氮气 C 乙烷 D 一氧化氮
16、某溶液中Cl-、Br-、I‑三者物质的量之比是1:2:3,通入一定量的Cl2,当反应完全后,该比值变为3:2:1,则反应的Cl2和原溶液中I-的物质的量之比是
A 1:2 B 1:3 C 1:4 D 1:6
15、加热碳酸镁和氧化镁的混合物mg,使之完全反应,得剩余物ng,则原混合物中氧化镁的质量分数为
A 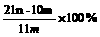 B
B 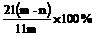 C
C  D
D 
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com