
题目列表(包括答案和解析)
17.今有甲、乙、丙三瓶等体积的新制氯水,浓度均为0.1 mol·L-1。如果在甲瓶中加入少量的NaHCO3晶体(mmol),在乙瓶中加入少量的NaHSO3晶体(mmol),丙瓶不变。片刻后,甲、乙、丙三瓶溶液中HClO的物质的量浓度大小关系是(溶液体积变化忽略不计)
A.甲=乙>丙 B.甲>丙>乙
C.丙>甲=乙 D.乙>丙>甲
16.物质的量浓度相同(0.1mol/L)的弱酸HX和NaX溶液等体积混合后,溶液中微粒浓度关系错误的是
A.c(Na+)+ c(H+)= c(X-)+ c(OH-)
B.c(HX )+ c(X-)= c(Na+)
C.若溶液呈酸性,则c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-)
D.若溶液呈碱性,则c(Na+)>c(HX)> c(X-)>c(OH-)>c(H+)
15.在一密闭容器中,用等物质的量的A和B发生如下反应:A(g)+2B(g) 2C(g),反应达到平衡时,A的转化率为0.4。则平衡混合物中物质的量n(A)、n(B)和n(C)应满足的关系是
2C(g),反应达到平衡时,A的转化率为0.4。则平衡混合物中物质的量n(A)、n(B)和n(C)应满足的关系是
A.n(A)=n(C) B.n(B)=n(C)
C.n(A)+n(B)=n(C) D.n(B)+n(C)=n(A)
14.近年来用红外激光技术研究液氢时,发现分子间作用力也可引起粒子间的反应。在液氢中有氢分子和质子形成的H3+离子,其构型是等边三角形;H3+还可进一步形成Hn+。下列判断正确的是
A.H3+可在液氢中开成H5+、H7+、H9+
B.每个H3+粒子中含有2个质子
C.H3+可在液氢中形成H4+、H5+、H6+
D.H3+可广泛存在于固态、液态和气态氢中
13.在一密闭容器中。反应mA(g)+nB(g) pC(g)达平衡时,测得c(A)为0.5 mol•L-1 ;在温度不变的情况下,将容器体积增大一倍,当达到新的平衡时,测得c(A)=0.3
mol•L-1,则下列判断正确的是
pC(g)达平衡时,测得c(A)为0.5 mol•L-1 ;在温度不变的情况下,将容器体积增大一倍,当达到新的平衡时,测得c(A)=0.3
mol•L-1,则下列判断正确的是
A.化学计量数:m+n<p B.平衡向正反应方向移动了
C.物质B的转化率减小了 D.物质C的质量分数增加了
12.将1×10-3 mol•L-1的盐酸a L跟下列3种溶液混合后,溶液均成中性。
①1×10-3mol•L-1的氨水b L;②c(OH-)=1×10-3 mol•L-1的氨水c L;③c(OH-)=1×10-3 mol•L-1的Ba(OH)2 d L。其中a、b、c、d的关系正确的是
A.a=b>c>d B.b>a=d>c C.b>a>d>c D.c>a=d>b
11.酸溶液甲和碱溶液乙等体积混合后,溶液pH<7。以下叙述一定不符合这一情况的是
A.甲是弱酸,乙是强碱,混合后原酸碱完全中和
B.甲是强酸,乙是弱碱,混合前甲中c(H+)和乙中c(OH-)相等
C.甲是强酸,乙是强碱,混合前甲、乙的物质的量浓度相等
D.甲是弱酸,乙是强碱,混合前甲中c(H+)和乙中c(OH-)相等
10.下列各组离子能在指定溶液中,大量共存的是
①无色溶液中:K+,Cl-,Na+,H2PO4-,PO43-,SO42-
②使pH=11的溶液中:CO32-,Na+,AlO2-,NO3-,S2-,SO32-
③水电离的H+浓度c(H+)=10-12mol·L-1的溶液中:Cl-,HCO3-,NO3-,NH4+,S2O32-
④加入Mg能放出H2的溶液中:Mg2+,NH4+,Cl-,K+,SO42-
⑤使甲基橙变红的溶液中:Fe3+,MnO4-,NO3-,Na+,SO42-
⑥酸性溶液中:Fe2+,Al3+,NO3-,I-,Cl-,S2-
A.①②⑤ B.①③⑥ C.②④⑤ D.①②④
9.中学化学教材中有大量数据,下列为某同学对数据的利用情况,其中不正确的是
A.用溶解度数据判断煮沸Mg(HCO3)2溶液得到的产物是Mg(OH)2而不是MgCO3
B.用沸点数据推测将一些液体混合物用分馏的方法分离开来的可能性
C.用反应热数据的大小判断不同反应的反应速率的快慢
D.用原子(或离子)半径数据推断某些原子(或离子)氧化性或还原性的强弱
8.下列分子结构图中的大黑点表示原子序数小于10的元素的“原子实”(指原子除去最外层电子的剩余部分),小黑点表示没形成共价键的最外层电子,短线表示共价键。其中分子结构图与对应化学式关系错误的是
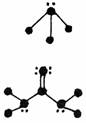
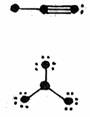 A.
(NH3) B.
(HCN)
A.
(NH3) B.
(HCN)
C. (C3H4O) D. (BF3)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com