
题目列表(包括答案和解析)
2.常温下,在10mL、0.2mol/L氨水中,滴入0.2mol/L的稀盐酸,使溶液pH=7。则下列说法正确的是
A.加入盐酸的体积大于10mL B.c(NH4+)=c(Cl-)
C.加入盐酸的体积等于10mL D.c(NH4+)<c(Cl-)
1.下列变化过程中,无化学键断裂或生成的是
A.石墨转化为金刚石 B.NaCl晶体溶于水
C.干冰升华 D.HCl溶于水
25.(9分)YBa2Cu3Ox是近年来科学家发现的一种高温超导材料。YBa2Cu3Ox中,Y、Ba、O三种元素都有固定的化合价,分别为+3、+2、-2,而Cu是+2和+3的混合价态,化学式中x为未知数。现用碘量法测Cu,进而求得x值。
取4.00×10-2g YBa2Cu3Ox样品,用稀盐酸溶解,在氩气保护下加1gKI固体。样品中的Cu3+和Cu2+分别氧化KI,再用0.0100mol/LNa2S2O3溶液滴定得到I2(Cu3++3I-=CuI+I2,2Cu2++4I-=2CuI+I2),终点时消耗Na2S2O3溶液23.45mL。另取一份质量相等的YBa2Cu3Ox样品,用稀盐酸溶解,煮沸,使其中的Cu3+全部转化为Cu2+,冷却后用碘量法滴定,终点时消耗18.13mL 0.0100 mol/L Na2S2O3(在滴定时S2O32-转变为S4O62-)。请回答下列问题:
(1)写出在滴定过程中S2O32转变为S4O62-离子方程式。
(2)求出Cu3+和Cu2+物质的量之比。
24.(6分)某温度下,将一定量的密度为1.15g/L的NaCl溶液电解(惰性电极),设NaCl
恰好完全电解且无其它反应发生时,得到的溶液中氧元素的质量分数为80%。
求:(1)电解后溶液中溶济和溶质的物质的量之比。
(2)原溶液的物质的量浓度。
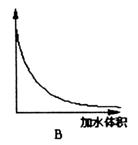
23.(9分)为测定冰醋酸在加水稀释的过程中溶液导电能力的变化,某学生用下图所示仪器设计了一个实验。
(1)请将下图所示仪器间没有连接的部分用导线连接起来完成本实验。
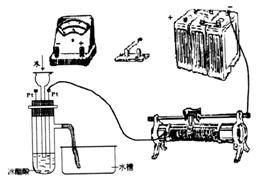
(2)电路开关闭合为t0时刻,之后向长颈漏斗中持续加入蒸馏水,并分别在t1、t2、t3时刻观察到电流计指针的偏转情况如下(其中t1< t2< t3,且在实验全过程上t2时刻电流计指针偏转为最大):
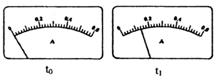
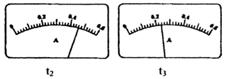
请据此信息分析,在t1到t2的过程中,溶液中c (H+)(填“增大”“减小”或“不变”)__________;继续加水,在t2到t3的过程上,溶液中c (H+)(填“增大”“减小”或“不变”)_________;请用简要文字解释冰醋酸在稀释过程中c (H+)变化的原因_____________。
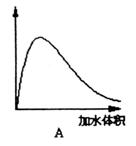
(3)下图中横坐标均表示向一定量冰醋酸中加入水的体积,请判断图中纵坐标的意义并填空:纵坐标表示(请填选项字母):醋酸的电离度________;醋酸的浓度________;溶液的导电能力________。

22.(4分)试利用你家里的一些物品,设计一原电池,画出其原理图,并说明检测电流的方法.
21.(10分)已知某溶液中只存在OH-、H+、Na+、CH3COO-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
① c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
② c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
③ c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
④ c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
填写下列空白:
(1)若溶液中只溶解了一种溶质,则该溶质是____________,上述四种离子浓度的大小顺序为_______(填序号)。
(2)若上述关系中①是正确的,则溶液中的溶质为____________;若上述关系中④是正确的,则溶液中的溶质为____________。
(3)若该溶液是由体积相等的稀醋酸和NaOH溶液混合而成,且恰好呈中性,则混合前c(CH3COOH)______c (NaOH)(填“大于”、“小于”或“等于”,下同),混合前酸溶液中c(H+)和碱溶液中c(OH-)的关系c(H+)______c(OH-)。
20.(10分)A、B、C、D、E、F六种短周期元素的原子序数依次增大。A、D同族,B、C同周期,C是F不同周期的邻族元素。B原子最外层电子数比其次外层电子数多2;A、B两种元素的核电核数之差等于它们的原子最外层电子数之和;E和F 的原子序数之和为30。现有由上述六种元素中的两种元素组成的甲、乙、丙、丁、戊、己六种化合物,这些化合物中的原子个数比如下表:
|
化合物 |
各元素原子个数比 |
|
甲 |
N(A)︰N (C)=2︰1 |
|
乙 |
N(A)︰N (C)=1︰1 |
|
丙 |
N(B)︰N (A)=1︰1 |
|
丁 |
N(D)︰N (C)=1︰1 |
|
戊 |
N(E)︰N (F)=1︰3 |
|
己 |
N(B)︰N (F)=1︰4 |
请回答下列问题:
(1)化合物己的电子式为_________________。
(2)向乙的水溶液中加入MnO2,其氧化产物是________________。
(3)化合物丙中所有的原子都在同一直线上,实验室制取丙的化学方程式为_________________________________________。
(4)F的单质与甲反应的离子方程式为____________________________。
(5)戊与足量丁投入甲中发生反应的总化学方程式为:
____________________________________________________________。
19.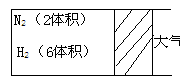 (6分)在一定温度下,把2体积
(6分)在一定温度下,把2体积
N2和6体积H2通入一个带有活塞的容积
可变的容器中,活塞的一端与大气相通,
发生反应N2(g)+3H2(g)  2NH3 (g) ;
2NH3 (g) ;
ΔH<0达到平衡,测得混合气体为7体积。
(1)保持上述反应温度不变,设a、b、c分别代表初始加入的N2、H2、NH3体积,若反应达到平衡后,混合气体中各物质的百分含量仍与上述平衡完全相同,那么:
若a=1, c=2则b=_____,在此情况下,反应起始时将向_____方向进行。
若规定起始时反应向逆方向进行,则C的取值范围是______________。
(2)在上述装置中,若起始时的a、b、c值均与(1)相同,但需控制平衡后混合气体为6.5体积,则可采取措施是______,其原因是__ ____。
18. 如图所示,x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,下列组合符合这一情况的是
如图所示,x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,下列组合符合这一情况的是
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com