
题目列表(包括答案和解析)
22.(4分)试利用你家里的一些物品,设计一原电池,画出其原理图,并说明检测电流的方法.
21.(10分)已知某溶液中只存在OH-、H+、Na+、CH3COO-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
① c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
② c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
③ c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
④ c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
填写下列空白:
(1)若溶液中只溶解了一种溶质,则该溶质是____________,上述四种离子浓度的大小顺序为_______(填序号)。
(2)若上述关系中①是正确的,则溶液中的溶质为____________;若上述关系中④是正确的,则溶液中的溶质为____________。
(3)若该溶液是由体积相等的稀醋酸和NaOH溶液混合而成,且恰好呈中性,则混合前c(CH3COOH)______c (NaOH)(填“大于”、“小于”或“等于”,下同),混合前酸溶液中c(H+)和碱溶液中c(OH-)的关系c(H+)______c(OH-)。
20.(10分)A、B、C、D、E、F六种短周期元素的原子序数依次增大。A、D同族,B、C同周期,C是F不同周期的邻族元素。B原子最外层电子数比其次外层电子数多2;A、B两种元素的核电核数之差等于它们的原子最外层电子数之和;E和F 的原子序数之和为30。现有由上述六种元素中的两种元素组成的甲、乙、丙、丁、戊、己六种化合物,这些化合物中的原子个数比如下表:
|
化合物 |
各元素原子个数比 |
|
甲 |
N(A)︰N (C)=2︰1 |
|
乙 |
N(A)︰N (C)=1︰1 |
|
丙 |
N(B)︰N (A)=1︰1 |
|
丁 |
N(D)︰N (C)=1︰1 |
|
戊 |
N(E)︰N (F)=1︰3 |
|
己 |
N(B)︰N (F)=1︰4 |
请回答下列问题:
(1)化合物己的电子式为_________________。
(2)向乙的水溶液中加入MnO2,其氧化产物是________________。
(3)化合物丙中所有的原子都在同一直线上,实验室制取丙的化学方程式为_________________________________________。
(4)F的单质与甲反应的离子方程式为____________________________。
(5)戊与足量丁投入甲中发生反应的总化学方程式为:
____________________________________________________________。
19.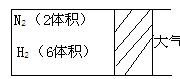 (6分)在一定温度下,把2体积
(6分)在一定温度下,把2体积
N2和6体积H2通入一个带有活塞的容积
可变的容器中,活塞的一端与大气相通,
发生反应N2(g)+3H2(g) 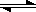 2NH3 (g) ;
2NH3 (g) ;
ΔH<0达到平衡,测得混合气体为7体积。
(1)保持上述反应温度不变,设a、b、c分别代表初始加入的N2、H2、NH3体积,若反应达到平衡后,混合气体中各物质的百分含量仍与上述平衡完全相同,那么:
若a=1, c=2则b=_____,在此情况下,反应起始时将向_____方向进行。
若规定起始时反应向逆方向进行,则C的取值范围是______________。
(2)在上述装置中,若起始时的a、b、c值均与(1)相同,但需控制平衡后混合气体为6.5体积,则可采取措施是______,其原因是__ ____。
18.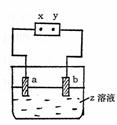 如图所示,x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,下列组合符合这一情况的是
如图所示,x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,下列组合符合这一情况的是
|
17.今有甲、乙、丙三瓶等体积的新制氯水,浓度均为0.1 mol·L-1。如果在甲瓶中加入少量的NaHCO3晶体(mmol),在乙瓶中加入少量的NaHSO3晶体(mmol),丙瓶不变。片刻后,甲、乙、丙三瓶溶液中HClO的物质的量浓度大小关系是(溶液体积变化忽略不计)
A.甲=乙>丙 B.甲>丙>乙
C.丙>甲=乙 D.乙>丙>甲
16.物质的量浓度相同(0.1mol/L)的弱酸HX和NaX溶液等体积混合后,溶液中微粒浓度关系错误的是
A.c(Na+)+ c(H+)= c(X-)+ c(OH-)
B.c(HX )+ c(X-)= c(Na+)
C.若溶液呈酸性,则c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-)
D.若溶液呈碱性,则c(Na+)>c(HX)> c(X-)>c(OH-)>c(H+)
15.在一密闭容器中,用等物质的量的A和B发生如下反应:A(g)+2B(g) 2C(g),反应达到平衡时,A的转化率为0.4。则平衡混合物中物质的量n(A)、n(B)和n(C)应满足的关系是
2C(g),反应达到平衡时,A的转化率为0.4。则平衡混合物中物质的量n(A)、n(B)和n(C)应满足的关系是
A.n(A)=n(C) B.n(B)=n(C)
C.n(A)+n(B)=n(C) D.n(B)+n(C)=n(A)
14.近年来用红外激光技术研究液氢时,发现分子间作用力也可引起粒子间的反应。在液氢中有氢分子和质子形成的H3+离子,其构型是等边三角形;H3+还可进一步形成Hn+。下列判断正确的是
A.H3+可在液氢中开成H5+、H7+、H9+
B.每个H3+粒子中含有2个质子
C.H3+可在液氢中形成H4+、H5+、H6+
D.H3+可广泛存在于固态、液态和气态氢中
13.在一密闭容器中。反应mA(g)+nB(g) pC(g)达平衡时,测得c(A)为0.5 mol•L-1 ;在温度不变的情况下,将容器体积增大一倍,当达到新的平衡时,测得c(A)=0.3
mol•L-1,则下列判断正确的是
pC(g)达平衡时,测得c(A)为0.5 mol•L-1 ;在温度不变的情况下,将容器体积增大一倍,当达到新的平衡时,测得c(A)=0.3
mol•L-1,则下列判断正确的是
A.化学计量数:m+n<p B.平衡向正反应方向移动了
C.物质B的转化率减小了 D.物质C的质量分数增加了
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com