
题目列表(包括答案和解析)
26. (本小题共分) 现有Fe、Cu组成的合金,其中Fe、Cu的总物质的量为a mol,Cu的物质的量分数为x,全部投入含b mol HNO3的稀溶液中,且硝酸的还原产物只有NO,试回答下列问题:已知:Cu+2Fe3+=2Fe2++Cu2+)
(1)HNO3用量的增加,溶液中的金属离子和残留固体的成分依次有多种情况,请用粒子符号,填写下列空白:(可填满,也可不填满)
|
|
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
|
溶液中的金属离子 |
|
|
|
|
|
|
|
|
残留固体成份 |
|
|
|
|
|
|
|
(2)当溶液中金属离子只有Fe2+、Cu2+时,求b的取值范围。
(3)当x=0.5时,溶液中 Fe2+与Fe3+的物质的量相等时,在标准状况共产生672mL气体。求a、b的值。
25.(本小题共6分) 铁铝硅合金13.6g分成两份 , 一份溶于足量烧碱溶液, 另一份溶于足量盐酸溶液生成的气体均是784mL(标准状态), 原合金各成份物质的量分别是多少?
24.(本小题共8分) 铁是自然界里分布最广的金属元素之一,在地壳中的质量约占5%左右。铁矿石的种类很多,重要的有磁铁矿石(主要成分是Fe3O4)、赤铁矿石(主要成分为Fe2O3)等。工业上用一氧化碳作还原剂炼铁。铁及其化合物是生活、生产中必须的元素之一。
(l)写出工业用赤铁矿炼铁的主要化学反应式:____________________________
(2)红热的铁能与水蒸气起反应,有一种产物是可燃气体,则其反应式为:_______________________________________________。在常温下,铁跟水不起反应。但是,在水和空气里的氧气及二氧化碳等的共同作用下,铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢材年产量的四分之一。刷油漆是重要的防腐蚀措施之一。油漆防腐蚀的主要原因是______________________________________________。
(3) 一种冬季用“热敷袋”,内盛还原铁粉、碳粉及其它必要物质,用力搓此袋,袋则发热。请解释可能的原因______________________________________________________。
23.(本小题共11分) 化学实验中,如使某步骤中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质(称之为零排放)。例如:

 Na2Cr2O7 ①
CrCl3
②
Cr(OH)3
Na2Cr2O7 ①
CrCl3
②
Cr(OH)3

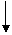

④ ⑤ ③
 Na2CrO4
NaCrO2
Na2CrO4
NaCrO2
(1) 在上述有编号的步骤中,需用还原剂的是_______,需用氧化剂的是_______(填编号)。
(2) 在上述循环中,既能与强酸反应又能与强碱反应的两性物质是_________(填化学式), 体现两性的离子方程式是___________________________,__________________________
(3)完成并配平步骤①的化学方程式:
□Na2Cr2O7+□ KI+□ HCl→□CrCl3+□NaCl+□KCl+□I2+□______
22.(本小题共8分)已知某些卤化物和浓硫酸反应生成卤化氢,如:NaX+H2SO4(浓)==NaHSO4+HX↑。A、B、C、D、E、F是中学化学中常见的6种物质,它们之间有如下转化关系:
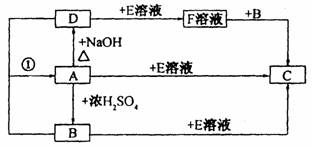
其中B、D在常温常压下为气态物质,F溶液呈现碱性,C是一种不溶于稀硝酸的白色沉淀。
(1)写出C的化学式_______________。
(2)写出反应①的化学方程式_______________________________________________
(3)写出F溶液与盐酸反应的离子方程式________________________________________。
21.(本小题共8分) Fe3O4可写成FeO·Fe2O3,若看作盐则可写成Fe(FeO2)2。根据化合价规律和以上书写方法,若将Pb3O4看成盐则可写为___________,看作氧化物则可以类似形式写成_____。已知等物质的量的Fe3O4和Pb3O4分别在一定条件下均可以与浓盐酸反应,且消耗等量的盐酸,所不同的是高价铅能将盐酸氧化为 C12。试写出 Fe3O4和Pb3O4分别与浓盐酸反应的两个化学反应方程式:____________________________________;
___________________________________________。
(五)问题和讨论
实验完成后,老师评议说:按上述实验设计,即使C中反应完全,D中吸收完全,也不会得出正确的结果。经讨论,有同学提出在B与C之间加入一个装置,再次实验后,得到了较正确的结果,那么,原来实验所测得的铜的质量分数偏小的原因可能是_________________________,在B与C之间加入的装置可以_____________,其中盛放的药品是______________。
(四) 计算:样品中铜的质量分数=___________(用含w 、m 、m2 的代表式表示)
(三)实验内容;
|
实验步骤 |
 实验现象 实验现象 |
 有关化学方程式 有关化学方程式 |
|
在C中加入样品粉 末wg,D中装入药 品后并称重量为mg 连接好仪器后,检查气密性 |
|
|
|
打开A的活塞,慢
慢滴加溶液 |
|
|
|
对C进行加热。 当C中的药品充分 反应后。关闭A的 活塞,停止加热 |
 |
 |
|
冷却后,称量D的 质量为m2 g |
|
|
(二)实验用品:
仪器:天平、分液漏斗、锥形瓶、硬质玻璃管、干燥管、
酒精灯、洗气瓶等
药品:红褐色铜粉(含炭)样品、过氧化氢溶液,二氧化锰、碱石灰、浓硫酸等
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com