
题目列表(包括答案和解析)
22.(1)用碳酸钙与稀硝酸反应产生的二氧化碳气赶走装置内的空气;
(2)3Cu+8HNO3 3Cu(NO3)2+2NO2↑+4H2O;
3Cu(NO3)2+2NO2↑+4H2O;
CO2比空气重,从长管进入E,并没有把E中空气赶尽,致使部分NO先与未赶尽的空气生成少量红棕色NO2,当再从F鼓入空气时,E中有更多NO2生成,所以红棕色加深;
二氧化氮与水反应有硝酸生成,硝酸与碳酸钙反应使沉淀溶解;
(3)吸收NO、NO2、CO2尾气,防止污染大气。
②在水槽,用玻璃片盖住集气瓶口,按住玻璃片,小心把集气瓶移出水面,正放在桌上,用带火星的木条插入瓶口,木条迅速燃烧,证明Y是O2
22.(1)把反应器B中产生的CO2气体送入干燥管D中;NaOH溶液;除去空气中的CO2;偏大
(2)浓硫酸;干燥CO2(吸水);偏大。
(3)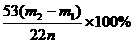
(4)防止空气中水蒸汽、二氧化碳气进入干燥管D。
21.(1)浓H2SO4(2)澄清石灰水(3)B;A。B。(4)A (5)B
9.AD 10.AC 11.AD 12.AD 13.B 14.B 15.A 16.CD 17.BC 18.BD 19.C 20.C
1.D 2.D 3.D 4.A 5.B 6.B 7.B 8.D
25.(13分)下图A-J分别代表有关反应中的一种物质,它们均为中学化学中的常见物质。已知A-E和F-J中分别含有同一种元素。反应E→A+O2的条件未标出。

请填写下列空白:
(1)化合物H中的阳离子_______;D的化学式___________。
(2)A生成B反应的离子方程式是______________________________________。
(3)A和F的混合物叫做___________,发生反应的化学方程式是
_________________________________________________________________。
(4)I→J反应的化学方程式是___________________________________________。
该反应过程中发生的现象是_________________________________________。
高三化学专题检测:化学实验答案
24.(15分)图是一个制取氯气并以氯气为原料进行特定反应的装置:

(1)A是氯气发生装置,其中的化学反应方程为
(2)实验开始时,先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处酒精灯,连接上E装置。Cl2通过C瓶后再进入D。D装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为CO2和HCl。试写出D中反应的化学方程式: 。装置C的作用是 。
(3)在E处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是 。
(4)若将E处烧杯中溶液改为澄清石灰水,反应过程现象为 。
(选填标号)
(A)有白色沉淀生成 (B)无现象
(C)先生成白色沉淀,而后白色沉淀消失
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有Cl2产生,此时B中的现象是 ,B的作用是 。
23.(13分)为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置 如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。
如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。
(1)实验时,先将B装置下移,使碳酸钙与稀硝酸接触产生气体,当C处产生白色沉淀时,立刻将B装置上提,使之与稀硝酸分离。该组学生设计此步操作的目的为 。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的化学方程式为 。
装置E中开始时出现浅红棕色气体,用F向E中鼓入空气后,可观察到烧并E内气体颜色加深,产生上述现象的原因是 。一段时间后,C中白色沉淀溶解,其原因 。
(3)装置D的作用是 。
22.(15分)纯碱中常含有少量的NaCl等杂质,利用下图仪器装置可用于测定纯碱中Na2CO3的质量百分含量(即质量分数)。
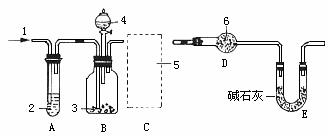
图中:1.空气 2.某溶液 3.纯碱 4.稀H2SO4 6.碱石灰
其实验步骤是:
a.按上图所示,组装好实验仪器,并检查其气密性;
b.准确称量盛有碱石灰的干燥管D的质量(设为m 1 g);
c.准确称量一定量的纯碱(设为ng),并将其放进广口瓶内;
d.从分液漏斗中缓缓滴入一定量稀硫酸,并从“1”处缓缓鼓入空气,至B反应器中不再产生气体为止;
e.准确称量干燥管D的总质量(设m 2 g)。
根据上述实验,回答下列问题:
(1)该实验进行到操作d时,要缓缓鼓入空气,鼓入空气的作用是 。装置A中盛装的液体“2”应选用_ ;装置A的作用是 ;如果撤去装置A,直接向装置B中缓缓鼓入空气,则会导致实验测定结果 (填偏大、偏小或不变)。
(2)在空白格内画出装置C及试剂;装置C盛放的试剂“5”是 ;说明装置C的作用是 ;如果撤去装置C,则会导致实验测定结果 (填偏大、偏小或不变)。
(3)根据此实验,计算纯碱中Na2CO3的质量百分含量(即质量分数)的数学式为 。(用m1、m2、n表示)
(4)装置E的作用是 。
21. (12分)右图所示装置有多种用途,请回答下列问题:
(12分)右图所示装置有多种用途,请回答下列问题:
(1)洗气:除去CO中的水蒸气,装置内应盛
(2)检验:证明CO中混有CO2,装置内应盛
(3)集气:若用排空气法收集比空气轻的气体时,气体应从装置的
端通人(填A或B,下同);若收集比空气重的气体,则气体从 端通人。若用排水法收集O2时,瓶内应先装满水,气体从 端通人。
(4)贮气:若要用水将装置中的氧气排出进行实验时,水应
从 端通人。
(5)量气:若要测定实验室制得的少量O2的体积,则应在瓶内先装满水,再将O2从
端通入。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com