
题目列表(包括答案和解析)
2.分子晶体具有的本质特征是
(A)组成晶体的微粒是分子 (B)熔点一般比原子晶体低
(C)熔融时不导电 (D)晶体内微粒间以范德华力相结合
1.下列各组物质气化或熔化时,所克服的微粒间的作用(力),属同种类型的是
(A)碘和干冰的升华 (B)二氧化硅和生石灰的熔化
(C)氯化钠和铁的熔化 (D)苯和已烷的蒸发
(四)计算
20.将一块部分被氧化的Na投入盛满水的且倒置于水槽内的溶器中,最终在容器中可收集到448mL(S、T、P)气体.以电火花引燃容器里的气体,气体的体积最终减少到112mL(S、T、P),经测知,水槽和容器内溶液总体积为800mL.溶液的PH值为13.求金属钠及其各种氧化产物的物质的量.
(三)作图
19.将22.4g铁粉逐渐加入到含HNO30.8mol的稀硝酸中,试画出Fe2+、H+、NO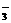 离子的物质的量随消耗的铁粉的物质的量变化的关系图象.
离子的物质的量随消耗的铁粉的物质的量变化的关系图象.

(二)填空
16.将a mol Na2O2和b mol NaHCO3固体混合物,在密闭容器中加热到250oC,让其充分反应.
(1)当剩余固体为Na2CO3,排出气体为O2、H2O时,a/b=____________
(2)当剩余固体为Na2CO3、NaOH,排出气体为O2、H2O时,则a/b的取值范围为_______
(3)当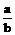 >1时,剩余固体为_________,排出气体为___________
>1时,剩余固体为_________,排出气体为___________
(4)当排出的O2和H2O为等物质的量时,则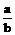 =_______________
=_______________
17.向含有amolNa2S和bmolNa2S2O3的混合溶液中,慢慢加入足量的稀H2SO4,使其充分反应后得到沉淀xmol和标况下的气体yL.
(1)计算推测当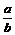 的取值范围不同时,x、y的值(用含a、b的式子表示),并推测所得气体的成分,将结果填入下表(不一定填表,若无气体产生,气体成分请填“无”)
的取值范围不同时,x、y的值(用含a、b的式子表示),并推测所得气体的成分,将结果填入下表(不一定填表,若无气体产生,气体成分请填“无”)
|
编号 |
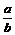 的范围 的范围 |
x |
y |
气体成分 |
|
① |
|
|
|
|
|
② |
|
|
|
|
|
③ |
|
|
|
|
(2)若X=a+b,写成a与b的函数关系式__________________.
18.现有Fe和Cu组成的合金共amol,其中Cu的物质的量的分数为x,研成粉末状后全部投入含bmolHNO3的稀溶液中,微热使其充分反应,且HNO3的还原产物只有NO,试回答下列问题:
(1)用化学符号填写下列空白(列出全部可能情况)
组序 ① ② ③ ④ ⑤ ⑥
残留固体成分
溶液中金属离子
(2)当溶液中金属离子只有Fe2+、Cu2+时,则b的取值范围是_____________(用a、x表示)
(3)当x=0.5,溶液中Fe2+和Fe3+的物质的量相等时,在标况下共产生672mLNO气体,求a和b的值.
(一)选择
1.今有Cl2和H2的混合气体bL(S、T、P),点然使之充分反应后,将所得气体通入含有
a mol NaOH溶液中,最后得盐a mol,则b与a的关系不可能为 ( )
A.b=22.4a B.b<22.4a
C.b>22.4a D.b≤11.2a
2.用浓H2SO4吸收SO3可以得到H2SO4·SO3.若用1kg 98%的H2SO4充分吸收SO3后,进行
稀释,可得到98%的硫酸质量为 ( )
A.1.98 kg B.2.00 kg
C.2.22 kg D.2.42 kg
3.某CuO粉末与适量硫酸溶液在微热条件下充分反应后,恰好全部形成CuSO4·5H2O,
则此硫酸溶液的质量分数为 ( )
A.98% B.50% C.57.65% D.70%
4.在标况下,将CO和CO2的混合气体(VCO: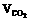 =3:1)充满一容积为22.4L且盛有足
=3:1)充满一容积为22.4L且盛有足
量Na2O2的密闭容器中,用间断的电火花引发反应至完全.下列对容器里最后存在
的物质及其物质的量的判断均正确的是(忽略固体占有的体积) ( )
A.0.5mol Na2CO3, 0.25mol CO
B.0.125mol O2, 1mol Na2CO3
C.0.5mol CO, 0.5mol Na2CO3
D.0.75mol Na2CO3, 0.25mol CO
5.将KCl和CrCl3两种固体共熔制得化合物x,x由K、Cr、Cl三种元素组成.将1.892g
x中的Cr元素全部氧化为Cr2O72-,这时,Cr2O72-可从过量的KI溶液中氧化出2。667g
单质.
Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O
如果取溶有1.892g x的溶液,加入过量的AgNO3溶液可制得AgCl4.52g,则x的化学
式可能为 ( )
A.K3 Cr2 Cl9 B.K3 Cr2 Cl7 C.K3 Cr2 Cl5 D.K2 Cr Cl4
 6.可逆反应: C(S)+H2O(g) CO(g)+H2(g)-Q在密闭容器内,一定温度、压力下达到
6.可逆反应: C(S)+H2O(g) CO(g)+H2(g)-Q在密闭容器内,一定温度、压力下达到
平衡状态,测得其密度为相同状况下H2的6倍.若压强不变,升高温度,达到新平衡
时混合气体的平均分子量与原来相比 ( )
A.不变 B.增大 C.减小 D.不能确定
7.有4.8g CuO、Fe2O3的混合物与充足CO加热时充分反应,反应后全部气体用
0.6mol/L Ba(OH)2溶液100mL处理,有白色沉淀,又知反应后固体质量为3.52g.
下列有关叙述正确的是( )
A.原混合物中CuO与Fe2O3的物质的量之比为1:1
B.生成的CO2已被Ba(OH)2溶液完全吸收,Ba2+沉淀完全
C.在吸收CO2后的Ba(OH)2溶液中有Ba(HCO3)2
D.原混合物中CuO与Fe2O3的质量比为1:1
8.在10mL 0.01mol/L的纯碱溶液中,不断搅拌并逐滴加入1.2mL 0.05mol/L盐酸,完
全反应后在标况下生成CO2的体积为 ( )
A.1.344mL B.2.24OmL C.0.672mL D.0
9.有Na2CO3、NaHCO3、CaO和NaOH组成的混合物27.2g,把它们溶于足量的水中,充分
反应后,溶液中Ca2+、CO32-、HCO3-均转化为沉淀,将反应后容器内水分蒸干,最
后得到白色固体物质共29g,则原混合物中Na2CO3的质量是 ( )
A.10.6g B.5.3g C.5.9g D.无法确定
10.向4g由Fe、Al、Ba、Si组成的合金样品中加入20g 20%的盐酸,恰好完全反应,
经测定知所生成的混合氯化物粉末中含氯50%,则合金中金属的质量分数为( )
A.0.9426 B.0.9526 C.0.9626 D.0.9726
11.向含xmol Na2S2O3和ymol Na2S的混合溶液中,加入足量的稀H2SO4酸化,反应完
全后待沉淀(2x+y)mol,则原混合溶液中x与y的关系是 ( )
A.x=2y B.x=y/2 C.x<y/2 D.x>y/2
12.ag由Na和Al组成的混合物,将它放入足量的bg水中,得反应停止后,过滤后
称量得知有Cg不溶物,则滤液中的溶质是 ( )
A.NaOH B.NaOH和NaAlO2 C.NaAlO2 D.无法判断
13.将足量O2、CH4、Na2O2的密封于一密闭容器中,用电火花引燃混合物,反应结束后,若容器中温度为150℃,压强为零,且参与物质溶于水无气体产生,则O2、CH4、Na2O23种物质的质量之比必须是 ( )
A.8:8:117 B.4:8:117 C.8:4:117 D.2:2:39
14.有混合气体A(由NO、H2、CO2组成),通过过量的Na2O2后,变成混合气体B,将B引燃,使其充分反应,得到浓度为70%的硝酸溶液(无任何气体剩余)。则混合气体A中各气体的体积比V(NO):V(H2):V(CO2)为( )
A.1:2 :3 B. 2 :3: 6 C. 2: 4: 7 D. 1: 4: 7
15.在一定温度下,向m g碳酸钠饱和溶液中加入含有18O的碳酸钠粉末(Na2C18O3)a g(m>>a),且充分搅拌。下列说法正确的是
A.碳酸钠粉末不溶解,体系中固体质量为a g ;
B.溶液中测到含18O的碳酸根,体系中固体质量为a g ;
C.溶液中测不到含18O的碳酸根,体系中固体质量大于a g ;
D.溶液中测到含18O的碳酸根,体系中固体质量大于a g 。
(四)用图象法代替复杂的计算法进行判断
例1 等质量的Na、Mg、Al(设均为mg)分别与等体积含HCl1mol的稀HCl作用,试确定m的取值范围不同时,三种金属与稀盐酸反应产生H2量的大小关系.
解析 若用常规方法,则需在不同区间内求出各物质的量,然后再进行比较,相当繁杂,因为只需定性比较,因此借助图象来判断具有直观简便等优点.
HCl
- Na -  Mg -
Mg - 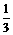 Al -
Al - 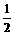 H2
H2
1mol 23g 12g 9g 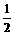 mol
mol
注意:Na -H2O- 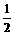 H2
H2
作图:nH2-m金属
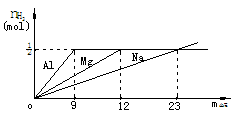
从图象可清楚地得出结论,
当0<m<12g时,产生H2量:Al>Mg>Na
当12≤m<23g时,产生H2量:Al=Mg>Na
当 m=23g时,产生H2量:Al=Mg=Na
当m>23g时,产生H2量:Na>Mg=Al
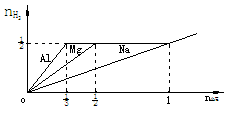
例2 在三份1mol/L 1L的盐酸中,分别加入nmol的Na、Mg、Al,放出H2amol、bmol、cmol.填空:
(1)当n为_____________时,a>b>c;
(2)当n为_____________时,a=b>c;
(3)当n为_____________时,a=b=c;
(4)当n为_____________时,c>a=b.
解析 用例1相似的方法
HCl- Na - 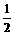 Mg -
Mg - 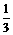 Al -
Al - 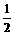 H2
H2
1mol
1mol 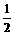 mol
mol 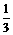 mol
mol 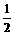 mol
mol
 Na -H2O-
Na -H2O- 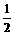 H2
H2
作图:nH2-n金属
从图中可知:
当0<n<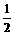 时,a>b>c;
时,a>b>c;
当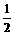 <n<1时,a=b>c;
<n<1时,a=b>c;
当n=1时,a=b=c;
当n>1时,c>a=b.
例3 各0.1molNa、Mg、Al分别投入至0.1mol/L VL盐酸中,填空:
V取值范围 放出H2量
(1)当V为__________,Na最多
(2)当V为__________,Mg、Al一样多
(3)当V为__________,Na、Mg、Al一样多
(4)当V为__________,Al最多
解析 少量只要HCl溶液中有足够的水使Na完全反应,放出H2量即为定值(0.05mol)
Mg - 2HCl -H2, Al - 3HCl - 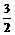 H2
H2
1
2 1
1
3
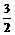
0.1 0.1V 0.1 0.1 0.1V 0.15
V=2L V=3L
 作图nH2-V
作图nH2-V
从图象可知:
(1)当0<V<1时,Na最多
(2)当V≤2时,Mg、Al一样多
(3)当V=1时,Na、Mg、Al一样多
(4)当V>2时,Al最多
巩 固 练 习
(三)函数型(含字母型)计算题
例1 取0.45molNaOH、0.35molNa2CO3和0.2molNaHCO3溶于水,在混合溶液中逐滴加入盐酸,仅应明显地分三个阶段进行.设加入盐酸的物质的量为nmol,溶液中随盐酸的加入,NaCl、Na2CO3、NaHCO3的物质的量分别xmol、ymol、zmol,试求X=f(n)、Y=f(n)、Z=f(n)的函数关系,并作出相应的函数图象.
解析 NaHCO3 + NaOH = Na2CO3 + H2O
0.2mol 0.2mol 0.2mol
混合反应后Na2CO30.55mol、NaOH0.25mol
逐滴加盐酸时,三步反应及其物质的量之间的关系如下:
①NaOH+HCl=NaCl+H2O
0.25 0.25 0.25
②Na2CO3+HCl=NaCl+NaHCO3
0.55 0.55 0.55 0.55
③NaHCO3+HCl=NaCl+CO2↑+H2O
0.55 0.55 0.55
各步反应消耗盐酸总量的临界值分别为0.25mol、0.8mol、1.35mol
(1)求x=f(n).
当0<n≤1.35时,加入HCl的物质的量即NaCl物质的量,x=n
当n>1.35时,HCl过量,x=1.35
故x=f(n)的函数表达式为:
|
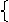 n (0<n≤1.35)
n (0<n≤1.35)
1.35 (n>1.35)
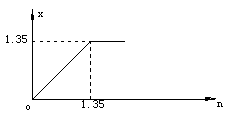 图象:
图象:
(2)求y=f(n)、z=f(n)
①当0<n≤0.25时,HCl仅与NaOH反应.
y=0.55,z=0
②当0.25<n≤0.8时,开始第二步反应,生成NaHCO3.
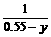 =
=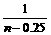 ,y=0.8-n
,y=0.8-n
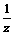 =
=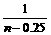 ,z=n-0.25
,z=n-0.25
③0.8<n≤1.35时,发生第三步反应
y=0
 =
=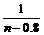 ,z=1.35-n
,z=1.35-n
④当n>1.35时,第三步反应也已完全
y=0,z=0.
故有
|
|
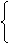
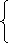 0.55 (0<n≤0.25)
0 (0<n≤0.25或n>1.35)
0.55 (0<n≤0.25)
0 (0<n≤0.25或n>1.35)
0.8-n (0.25<n≤0.8) n-0.25 (0.25<n≤0.8)
0 (n>0.8) 1.35-n (0.8<n≤1.35)
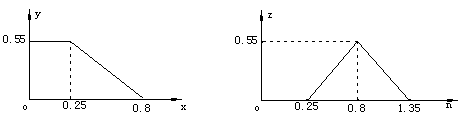 图象为:
图象为:
例2 氨氧化法可制得50%的HNO3,加脱水剂可进一步制备90%的HNO3,两种产品的质量比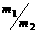 =x(m1、m2分别为50%、90%的HNO3溶液的质量.若以17t液氨为原料生产硝酸,试求:
=x(m1、m2分别为50%、90%的HNO3溶液的质量.若以17t液氨为原料生产硝酸,试求:
(1)导出理论所需水量(y)与质量比x的关系式(假定NH3转化率为100%)
(2)求出只生产50%的硝酸所需水量和只生产90%的硝酸所出水量
(3)当x为何值时,进出水量保持平衡,此时两种产品的总质量为多少吨?
解析 首先请思考这样一个问题:
将一定量的NH3完全氧化成HNO3全部溶解在反应生成的水中,这种硝酸溶液溶质的质量分数是多少?
该反应过程相当复杂,但可通过守恒写出总方程式
NH3+2O2=HNO3+H2O
63 18
HNO3%=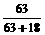 ×100%=77.8%
×100%=77.8%
当浓度为50%<77.8%,需加水,
当浓度为90%>77.8%,需出水.
由上关系式计,17tNH3制63tHNO3
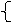 m1:m2=x
m1:m2=x
50%m1+90%m2=63
m2=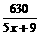 ……①
……①
理论所需水量=两种溶液中实际含水量-反应中生成的水量
y=(50%m1+10%m2)-18
=63-90%m2+10%m2-18
=45-80%m2 ……②
①代入②得
y=45-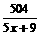
(2)只生产50%的HNO3,则m2=0,x→+∞.
y=45,即需加水45t
只生产90%的HNO3,则m1=0,x=0
y=45-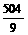 =45-56=-11
=45-56=-11
即需去水11t.
(3)进出水量平衡,即
y=0,则45-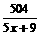 =0
=0
x=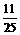
此时两种产品总质量即为反应生成的HNO3和水的质量之和.
即63+18=81(t)
|
|
NH4HCO3=NH3↑+CO2↑+H2O ……(2)
在密闭容器中加热碳酸氢铵和熟石灰的混合物共0.1mol,充分反应后得固体剩余物ag或以b(mol)表示混合物中NH4HCO3的物质的量,试通过计算确定b在不同的取值范围时,a值随b值变化的函数表达式.
解 (1)当NH4HCO3和Ca(OH)2以等物质的量(各0.05mol)相混合时,二者恰好完全反应,生成的固体只有CaCO3(0.05mol),a=0.05×100=5(g)
(2)当0<b<0.05时,NH4HCO3全部参加反应(1),且Ca(OH)2有剩余,所得固体有两种:
m总=mCaCO3+mCa(OH)2=100b+(1-2b) ×74
=(74-48b)g
(3)当0.05<b<0.1时,NH4HCO3在反应(1)有剩余,但又能发生反应(2),反应(2)无固体残留.故所得固体只有CaCO3(1-b)mol
a=100(1-b)g
例4 将总量为4mol的Na2O2和Al2(SO4)3混合物投入到足量水中,充分反应后生成ymol沉淀(y>0).若以x表示原混合物Na2O2的物质的量,试建立y=f(x)的函数关系式,将x取值和y=f(x)的关系式填在下表内并作图.
|
x值 |
y=f(x) |
|
|
|
|
|
|
|
|
|
解析 分两个阶段:
①沉淀开始生成至沉淀完全(直线上升)
②沉淀开始溶解至完全消失(直线下降)
先分析化学反应量的关系.令Na2O2xmol,则Al2(SO4)3为(4-x)mol
Na2O2-2NaOH-2OH-
x 2x
Al2(SO4)3-2Al3+
4-x 2(4-x)
后求出几个关键点
(1)当x=0,y=0(通过原点)
(2)Al(OH)3沉淀最大值(即最高点)
Al3+-3OH--Al(OH)3
1 3 1
|
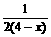 =
=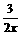 ,
,
(3)Al(OH)3完全溶解时
Al3+-4OH-
1 4
2(4-x) 2x
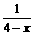 =
=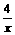
x=3.2mol,y=0
最终函数方程可用解析法求解.
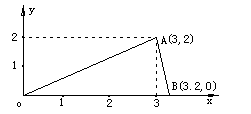
直线OA的斜率:
R=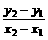 =
=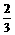 ,截距b=0
,截距b=0
y=kx=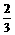 x
x
直线AB的斜率:
k=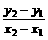 =
=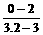 =
=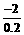 =-10
=-10
y-y0=k(x-x0)
y-0=-10(x-3.2)
y=32-10x
|
x值 |
y=f(x) |
|
0<x<3 |
y=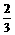 x x |
|
x=3 |
y=2 |
|
3.2>x>3 |
y=32-10x |
小结 函数型的计算题处理要点:
(1)找出变量x的取值范围,一般可根据临界反应确定临界点,然后分各区间依次取值讨论.
(2)根据化学计量关系来确定因变量y与x的关系.
(3)若为线性关系,可借用数学方法(解析法)处理.
(二)循环反应中的方程迭加法
例1 将xmL CO2通过足量的Na2O2后,再与ymL NO混合后,且x与y之和为30mL,充分反应后,同温同压下气体总体积缩小为15mL,则x:y为 ( )
①1:1 ②2:1 ③5:4 ④7:5
A.只有① B.只有①② C.只有②③ D.①②③④
解析 假如对4个选项不同的比值逐一具体求解,将是一种繁重的劳动.我们能否探求出一般规律呢?
分析各反应,然后进行加和处理
2Na2O2+2CO2=2Na2CO3+O2 …… (1)
2NO+O2=2NO2 …… (2)
(1)+(2): 2Na2O2+2CO2+2NO=2Na2CO3+2NO2
同÷2: Na2O2+CO2+NO=Na2CO3+NO2 △Vg …… (3)
1 1 1 1
当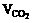 :
: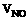 =1:1时, △Vg=
=1:1时, △Vg=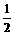 (x+y)
(x+y)
当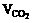 :
: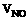 >1:1时,发生反应(3),(1). 这两反应有共同特征: △Vg=
>1:1时,发生反应(3),(1). 这两反应有共同特征: △Vg=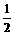 V始,故△Vg=
V始,故△Vg=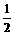 (x+y)
(x+y)
当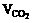 :
: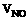 <1:1时,多余的NO无法再反应, △Vg<
<1:1时,多余的NO无法再反应, △Vg<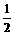 (x+y)
(x+y)
结论: 当x:y≥1:1时, △Vg=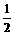 (x+y)
(x+y)
答案: D.
例2 在标准状况下,将密度为1.43g/L的CO、CO2混合气体5.6L,充入盛有足量Na2O2的密闭容器中,然后用电火花引燃容器内混合气体.直至所有物质完全反应.
(1)反应后容器内残留生成物是什么?质量为多少?
(2)反应后恢复到原温度,容器内压强为反应前压强的多少倍?
解析 (1)2CO2+2Na2O2=2Na2CO3+O2 …… (1)
|
 2CO+O2 2CO2
…… (2)
2CO+O2 2CO2
…… (2)
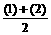 将CO+Na2O2=Na2CO3
将CO+Na2O2=Na2CO3
从总方程看出,无论CO2有多少,只要有其存在,CO就能被足量Na2O2完全吸收。但正因Na2O2足量,故最终CO2也不会存在,又将发生反应(1),产生O2.故最终容器内残留生成物为Na2CO3和O2.
根据C守恒: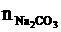 =
=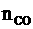 +
+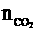 =
= =0.25(mol)
=0.25(mol)
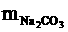 =106×0.25=26.5(g)
=106×0.25=26.5(g)
欲求得O2量,须求出原有CO2量.可根据气体平均分子量来求解.
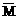 =1.43×22.4=32
=1.43×22.4=32



 CO2
44
4
CO2
44
4

 32
32
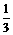

 CO
28 12
CO
28 12
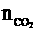 =
=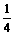 ·
·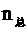 =
=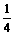 ×0.25=
×0.25=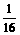 (mol)
(mol)
又2Na2O2+2CO2=2Na2CO3+O2
2 1
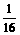
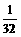
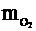 =
=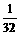 ×32=1(g)
×32=1(g)
(2)最终气体为O2, 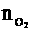 =
=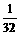 mol
mol
原有气体 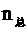 =
=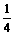 mol
mol
由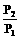 =
=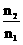 得
得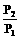 =
=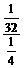 =
=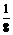
例3 已知某气态烃(CxHy)与O2的混合气体,在有足量Na2O2存在的密闭容器中,用电火花引爆时能充分反应.设CxHy、O2分别为amol、bmol.
(1)当a:b满足什么条件时,反应后容器内压强为零?
(2)若a:b分别为3:3和2:4时,充分反应后剩余的气体的物质的量相同.试求该烃可能的分子式.
解析 (1)分析可能发生的反应
 CxHy+(x+
CxHy+(x+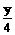 )O2 xCO2+
)O2 xCO2+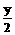 H2O
H2O
 2CO2+2Na2O2 2Na2CO3+O2
2CO2+2Na2O2 2Na2CO3+O2
 2H2O+2Na2O2 4NaOH+O2
2H2O+2Na2O2 4NaOH+O2
因Na2O2过量,烃燃烧生成的CO2和H2O一定完全反应,又最终容器内压强为O,即无气体存在.根据C、H分别完全转变成Na2CO3、NaOH且无O2存在,直接配平得总方程式
 CxHy+
CxHy+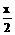 O2+(x+
O2+(x+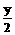 )Na2O2 xNa2CO3+yNaOH
)Na2O2 xNa2CO3+yNaOH
1 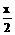
a b
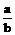 =
=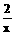
由此可见,为使反应后容器内压强为O,a/b值只与x有关,与y无关。
(2)当a/b值分别为3:3及2:4时,反应后余气物质的量相等,不难判断前者为烃过量,后者为O2过量.
从 CxHy-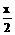 O2 关系式分析
O2 关系式分析
|
|
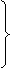 烃过量:
烃过量: 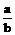 =
=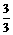 >
>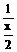 Þ x>2
Þ x>2
O2过量: 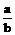 =
=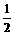 <
<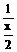 Þ x<4
Þ x<4
故烃可能的分子式为C3H4、C3H6、C3H8.
例4 500mL0.1mol/L FeCl2溶液中通入一定量Cl2,待反应完全后将所得溶液稀释到1L,再取出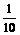 稀溶液,加入足量AgNO3溶液,能得到2.009g沉淀.问:
稀溶液,加入足量AgNO3溶液,能得到2.009g沉淀.问:
(1)原溶液中Fe2+是否完全被氧化?
(2)若未完全被氧化,求Fe2+被氧化的百分率.(不考虑Cl2与H2O的反应)
解析 本题是否也能用方程式加和来求解呢?请分析下列解法,错在何处?
2FeCl2+Cl2=2FeCl3 … (1)
FeCl3+3AgNO3=3AgCl↓+Fe(NO3)3 … (2)
(1)+(2)×2
2FeCl2+Cl2+6AgNO3=6AgCl↓+2Fe(NO3)3
设有xmolFeCl2被氧化
2FeCl2-6AgCl
2 6
x 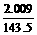
x=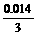 (mol)<0.005 mol
(mol)<0.005 mol
故Fe2+未被完全氧化.
氧化率: 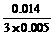 ×100%=93.3%
×100%=93.3%
错解分析: 误将沉淀中的Cl-完全来自于FeCl3中.事实上也可能因Cl2量不足,还剩余FeCl2,其中的Cl-也与Ag+反应生成AgCl.因此,本题不能用方程式迭加法求得.
正解: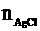 =
=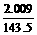 =0.014(mol)
=0.014(mol)
由Cl-守恒得:
10×0.014=0.5×0.1×2+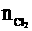 ×2
×2
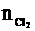 =0.02 mol
=0.02 mol
设有x mol FeCl2被氧化.
2FeCl2+Cl2=2FeCl3
2 1
x 0.02
x=0.04 mol < 0.05 mol.
Fe2+未被完全氧化
氧化率为: 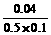 ×100%=80%.
×100%=80%.
(一)重视隐蔽性问题挖掘
化学习题中除了提供一些“显信息”外,有时还潜伏着“隐信息”,或者在常规中蕴含着特殊.这就要求我们打破思维定势的束缚,避免用习以为常的眼光来看待所有问题,善于发现和挖掘新问题,使自己具有敏锐的洞察力.
例1 在100mL某混合酸中,[HNO3]=0.4mol/L,[H2SO4]=0.1mol/L.向其中加入1.92g Cu粉,微热,充分反应后溶液中的[Cu2+]为
A.0.15mol/L B.0.3mol/L C.0.225mol/L D.无法计算
首先请看下列两种解法,指出错误原因.
解法一 因为Cu与稀H2SO4不反应,故只需考虑Cu与HNO3反应,设有xmol的Cu被氧化成Cu2+
3Cu+8HNO3=3Cu(NO3)2+2NO↑+H2O
3 8
x 0.4×0.1
x=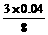 =0.015(mol)
=0.015(mol)
[Cu2+]=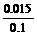 =0.15mol/L
=0.15mol/L
解法二 Cu与稀H2SO4不反应,但Cu与HNO3反应后生成的Cu(NO3)2,遇到H2SO4提供H+又相当于存在HNO3,故Cu完全被氧化.
nCu2+=nCu=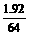 =0.03(mol)
=0.03(mol)
[Cu2+]=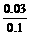 =0.3(mol/L)
=0.3(mol/L)
解析 显然,解法一的错误之处在于把混合酸当成单一酸独立处理,思维机械,缺乏灵活性和综合性.解法二较解法一进步一层,但H2SO4是否提供了足够的H+?未加判断.
处理Cu与HNO3、H2SO4混合酸反应情况,最好从离子反应方程式的系数关系来判断三者量的关系如何,然后确定以何者不足为计算的基准.三者反应的离子方程式为:
3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
一般有以下几种情况:
3Cu-2NO3--8H+ 被还原的HNO3量 被氧化的Cu量
① 足量 不足 足量
HNO3总量
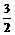 ·nHNO3
·nHNO3
② 不足 足量 足量
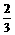 ·nCu
Cu总量
·nCu
Cu总量
③ 足量 足量 不足
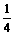 ·nH+
·nH+
 ·nH+
·nH+
由此看出,在不同的情况,HNO3可部分被还原,也可全部被还原,Cu也是可部分或可全部被氧化。
再来分析本例题情况:
3Cu - 2NO3- - 8H+
3 2 8
0.03mol 0.04mol 0.06mol
(足) (足) (不足)
按H+不足为计算基准,设有xmol Cu氧化为Cu2+.
3Cu -8H+-3Cu2+
3 8 3
x 0.06 x
x=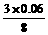 =0.0225(mol)
=0.0225(mol)
[Cu2+]=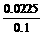 =0.225(mol/L)
=0.225(mol/L)
答案: C
例2 铜与某未知浓度的HNO3反应放出混合气体100mL(忽略水蒸气),该混合气体的密度是相同状况下H2密度的26.7倍,将此气体在密闭条件下用水充分吸收后,体积还有70mL(体积均为标况下)
(1)计算混合气体各组分的体积
(2)计算被氧化的Cu的质量
解析(1) 比较下列两种解法,哪种合理?
解法一
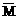 =26.7×2=53.4
=26.7×2=53.4
∵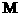 NO=30,
NO=30, 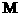 N O2=46,均<53.4
N O2=46,均<53.4
∴一定有N2O4
设原产生NO2 xL、 N2O4 yL、 NO zL
 因N2O4 2NO2,随着NO2不断被吸收,平衡右移,有ymolN2O4将又增加2ymolNO2,共有(x+2y)molNO2与H2O反应
因N2O4 2NO2,随着NO2不断被吸收,平衡右移,有ymolN2O4将又增加2ymolNO2,共有(x+2y)molNO2与H2O反应
3NO2+H2O=2HNO3+NO △V
3 2
x+2y 100-70
得 x+2y=45 ……(1)
又 x+y+z=100 ……(2)
46x+92y+30z=53.4×100 ……(3)
解(1)、(2)、(3)方程组得
y=54, z=109>100. x<0
显然,此解不合理.错在何处呢?
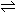 原因: 反应N2O4 2NO2引起的差量被忽视了.即前后减少的30mL气体体积并非完全由NO2与H2O反应引起的.由于差量成因分析疏漏,该解自然不合理.
原因: 反应N2O4 2NO2引起的差量被忽视了.即前后减少的30mL气体体积并非完全由NO2与H2O反应引起的.由于差量成因分析疏漏,该解自然不合理.
本题可用直接方法求解.
设原NO2、N2O4、NO仍分别为xmL、ymL、zmL.最终所得70mL为NO气体.即
z+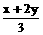 =70 …… (1)
=70 …… (1)
另有x+y+z=100 …… (2)
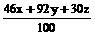 =53.4
…… (3)
=53.4
…… (3)
解(1)(2)(3)方程组得
x=30 (mL) … NO2的体积
y=30 (mL) … N2O4的体积
z=40 (mL) … NO的体积
(2)根据电子转移相等,设有Wg Cu被氧化
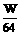 ×2=
×2=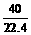 ×10-3×3+
×10-3×3+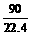 ×10-3×1
×10-3×1
W=0.3(g)
例3 向0.1mol/L的Fe(NO3)2溶液200mL中加入适量NaOH,使Fe2+恰好完全沉淀,小心加热此混合物直至水分蒸干后,灼烧到质量不再变化,此质量为 ( )
A. 4.36g B.5.54g C.5.2g D.5.0g
解 先分析反应:
Fe(NO3)2+2NaOH=2NaNO3+Fe(OH)2↓
|
|

|
 不少同学能注意到:Fe(OH)2 Fe2O3,但忽视了另一隐含反应: 2NaNO3 2NaNO2
不少同学能注意到:Fe(OH)2 Fe2O3,但忽视了另一隐含反应: 2NaNO3 2NaNO2
+O2↑.
因此最终固体应为Fe2O3和NaNO2的混合物.根据Fe、N原子分别守恒可得下列关系:
Fe(NO3)2
- 2NaNO2 - 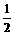 Fe2O3
Fe2O3
0.02mol 0.04mol 0.01mol
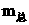 =
= +
+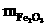
=0.04×69+0.01×160
=4.36(g)
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com