
题目列表(包括答案和解析)
7.接触法制硫酸中,进入接触室的气体的体积分数为SO27%、O211%、N282%。将100体积混合气体通入接触室反应后,导出的气体恢复到原状况时变为97.2体积。则SO2的转化率为 ( )
A.40% B.60% C.80% D.90%
6.在一定条件下能与某些酸、碱、金属和非金属反应的物质是 ( )
A.Al2O3 B.H2SO3 C.H2S D.NaHCO3
5.用稀硫酸溶解FeS和Fe(OH)3的混合物56.6 g,可得到3.2 g硫。则原混合物中FeS的质量可能是 ( )
A.8.8 g B.21.4 g C.35.2 g D.47.8 g
4.工业上常用铁屑跟H2SO4反应并经除杂、浓缩、结晶、干燥等过程,来制取绿矾晶体。为制得较纯净的绿矾晶体,合理的方法是 ( )
A.使硫酸过量 B.使铁屑过量 C.使用稀硫酸 D.使用浓硫酸
3.下列物质跟浓H2SO4反应时,浓H2SO4不表现氧化性的是 ( )
A.食盐 B.氟化钙 C.硫化氢 D.铜片
2.将溶质质量分数分别为5x%的H2SO4溶液与x%的H2SO4溶液等体积混合,其溶质质量分数与3x%相比 ( )
A.小于 B.大于 C.等于 D.无法确定
1.现有1 L含SO3为30%的发烟硫酸(密度为1.95 g/cm3),要把它稀释成质量分数为95%的浓硫酸,需加水约为 ( )
A.120 mL B.180 mL C.240 mL D.300 mL
25.有一包白色粉末可能含有下列阳离子和阴离子中的若干种。阳离子:K+、Na+、Fe2+、Fe3+、Cu2+、NH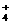 、Mg2+;阴离子:Cl-、SO
、Mg2+;阴离子:Cl-、SO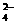 、SO
、SO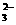 、CO
、CO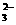 、HCO
、HCO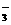 、S2-、MnO
、S2-、MnO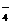 。
。
进行如下实验,并将观察到的现象如下:
|
实 验 方 法 |
现 象 |
|
①取少量试样加水则全溶 |
溶液呈无色透明 |
|
②将所得溶液加NaOH并加热 |
无可见现象 |
|
③取少量原粉末加入盐酸 |
无可见现象 |
⑴从实验①可推断粉末中无 离子;
⑵从实验②可推断粉末中不可能有 离子;
⑶根据实验③可推断粉末中无 离子。
综上所述,如果要进一步断定有无哪种离子,则还需进行怎样的操作,请简要说明。
24.鉴别可溶性硫酸盐、碳酸盐、亚硫酸盐、磷酸盐,可以采取以下从左到右的检验步骤:

试推断A、B、C、D及试剂a、b、c的名称。
A B C D
a b c
23.有一包固体混合物,可能是由氯化镁、氢氧化钠、氯化铜、氯化铵、明矾、硝酸钡这六种化合物中的几种混合而成。用它进行实验,记录如下:(l)混合物放在水中搅拌,得到无色无任何气味的透明溶液。向此溶液中滴入石蕊试液后呈蓝色。(2)向第一步实验所得的溶液中滴加稀硝酸,待溶液呈紫色时,有白色沉淀物出现;继续滴加稀硝酸,待溶液变红时,沉淀消失了,从以上实验可推断,此混合物由 组成。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com