
题目列表(包括答案和解析)
1.电解1 mol·L-1的硝酸银溶液,设电解时无水分蒸发,工作一段时间,在剩余溶液中加入下列物质使其恢复到原溶液的浓度的是( )
(A)Ag (B) Ag2O (C) Ag2CO3 (D) AgNO3
16.1982年,我国南方某城市郊区降了一场特大的酸雨,导致生态平衡受到严重破坏,郊农种植的西瓜全部死亡。我国政府于当年颁布了《关于开展全国酸雨普查的通知》,普查结果反映出我国酸雨降落的范围和酸度都较严重,酸雨已遍及我国西南、中南和华东地区。
酸雨是指pH小于5.6的各种大气降水,酸雨的形成是一种复杂的大气化学和大气物理现象,它是大气受污染的产物和表现。酸雨中含有多种无机酸和有机酸,多数情况下以硫酸为主。燃料燃烧、火山喷发、枯死植物腐烂、从含硫的金属矿石中提炼金属过程中都会产生二氧化硫,二氧化硫在空气和云中发生反应形成硫酸。
我国有许多燃煤电站,电站燃烧煤时产生了二氧化硫,为了减少二氧化硫的刺激,可在电站边建一座燃气脱硫工厂,工厂燃气脱硫工艺简图如下。请根据以上材料,结合所学知识回答:

[图-3]
⑴以上材料中,哪些是属于引起酸雨的人为因素?
⑵用化学方程式表示SO2形成酸雨的过程。
⑶酸雨不仅使土壤酸化,而且使土壤贫瘠,请说明酸雨使土壤贫瘠的原因。
⑷为减少电站的电能输送给远方时的能量损耗,采用何种输电方式比较合理?
⑸脱硫工艺简图中的A和B分别是什麽物质?
⑹你认为应该如何控制酸雨污染物,防止酸雨危害?
15.甘蔗厂在生产过程中需要使用SO2气体。为此需要在燃烧炉中燃烧硫磺。在生产中发现如下情况:当液态硫表面上空3 mm左右空间的温度为360-380 ℃时,燃烧硫磺的火焰为蓝色;温度超过450 ℃,火焰呈白色,此时硫磺消耗的速率加快,但SO2产率明显降低,在输送SO2的管道中随之出现严重堵塞现象。
⑴造成这种现象的原因是什么?⑵该步生产的关键是什么?
14.二氧化氮在加热条件下能够分解成一氧化氮和氧气。该反应进行到45s时达到平衡(NO2浓度约为0.0125 mol/L)。图中的曲线表示二氧化氮分解反应在前25s内的反应进程。
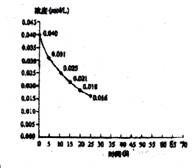
[图-2]
⑴请计算前20 s内O2的平均生成速率。
⑵若反应延续至70s,请在图中用实线画出25s至70s的反应进程曲线。
⑶若在反应开始时加入催化剂(其他条件都不变),请在图上用虚线画出加入催化剂后的反应进程曲线。
⑷写出该反应的化学平衡常数表达式。
13.⑴CuCl2有时呈黄色,有时呈黄绿色或蓝色,这是因为在CuCl2的水溶液中存在如下平衡:[Cu(H2O)4]2++ 4Cl- =[CuCl4]2- + 4H2O
蓝色 黄色
现欲使溶液由黄色变成黄绿色或蓝色,请写出两种可采用的方法。
⑵在2SO2+O2 ? 2SO3的平衡体系中,加入18O构成的氧气,当平衡发生移动后,SO2中18O的含量 (填“增加”、“减少”或“不变” ),其原因是 。
12.对于反应2A(g)+B(g) ? 2C(g)在反应过程中C的质量分数随温度变化如图,则:⑴T0对应的v正与v逆的关系是 ;
⑵正反应为 热反应;
⑶A、B两点正反应速率的大小关系是 ;
⑷温度T<T0时,C逐渐增大的原因是 。
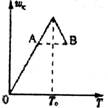
[图-1]
11.汽车尾气(含有烃类、CO、SO2与NO等物质)是城市空气的污染源,治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的转化。
⑴写出 CO与NO反应的化学方程式 。
⑵“催化转换器”的缺点是在一定程度上提高空气的酸度,其原因是 。
⑶控制城市空气污染源的方法可以有( )
A.开发氢能源 B.使用电动车 C.植树造林 D.戴上呼吸面具
10.在10.0 ℃和2×105 Pa的条件下,反应aA(g)?dD(g)+ eE(g)建立平衡后,再逐步增大体系的压强(温度维持不变)。下表列出不同压强下反应建立平衡时物质D的浓度。
|
压强/Pa |
2×105 |
5×105 |
1×106 |
|
D的浓度/(mol·L-1) |
0.085 |
0.2 |
0.44 |
根据表中数据,回答下列问题:
⑴压强从2×105 Pa增加到5×105 Pa时,平衡向 (填“正”、“逆”)反应方向移动,理由是 。
⑵压强从5×105 Pa增加到1×106 Pa时,平衡向 (填“正”、“逆”) 反应方向移动,理由是 ,平衡之所以向该方向移动,这是由于 。
9.据报道,1952年2月,某城市雾大无风,家庭和工厂排出的烟雾经久不散,每立方米大气中SO2的含量高达3.8 mg,烟尘达4.5 mg,居民健康普遍受到危害,4天之内死亡人数约 4 000多人。请回答下列问题:
⑴流经该城市的主要河道也因此受到污染,引起鱼类死亡,这与此种类型大气污染形成
有关;
⑵这种大气污染对人体 系统的危害最大,将会造成 等病症;
⑶大气中SO2将直接危害陆生高等植物的 组织;
⑷为了防止这种污染,硫酸厂可用氨水来吸收SO2,再用H2SO4处理,反应的离子方程式为 、 ;
⑸目前有一种比较有效的方法是:用直升飞机喷撒白垩粉以降解酸雨污染,其反应的离子方程式是 ;
⑹上述烟雾中含有另一种有害物质是NOx(NO2和NO),硝酸厂常用烧碱溶液来吸收氮的氧化物,其反应的离子方程式为 ;
⑺要防止类似悲剧出现,应采取的根本措施是 ;
⑻据调查,绿色区空气里细菌比闹市区的少7倍以上,其原因之一是有些植物能 而具有较强的杀菌能力。
8.某亚硫酸钠因长期存放已部分变质,某同学设计如下实验来确定其纯度:第一步,称取样品A g,需要的仪器和用品主要有 ;第二步,将样品溶解,用到的仪器主要有 ;第三步,在溶液中加入过量的用盐酸酸化的BaCl2溶液,①BaCl2溶液要用盐酸酸化的原因是 ;②BaCl2溶液要加过量的原因是 ;③检验BaCl2是否过量的方法是 ;第四步,过滤和洗涤沉淀。①过滤用的主要仪器有 ;②洗涤沉淀的原因是 ;③洗涤沉淀的方法是 ;④判断沉淀是否洗净的方法是 。第五步,烘干沉淀并计算。称量烘干后的沉淀为B g,则亚硫酸钠的纯度计算式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com