
题目列表(包括答案和解析)
24.现有铁和铜组成的合金共a mol,其中铜的物质的量分数为x,研成粉末状后全部投入含b mol HNO3的稀溶液中,微热使其充分反应,且HNO3的还原产物只有NO。
试回答下列问题:
(1) 用微粒符号填写下列空白(列举出全部的可能情况)
|
组序成分 |
① |
② |
③ |
④ |
⑤ |
|
|
残留固体成分 |
|
|
|
|
|
|
|
溶液中金属离子 |
|
|
|
|
|
|
(2)当溶液中金属离子只有Fe2+、Cu2+时,则b的取值范围是(用a、x表示)
。
(3)当x=0.5,溶液中Fe3+和Fe2+相等时,在标准状况下共产生672 mL NO气体,求a、b的值。
23.L、M、R、P、Q分别代表五种不同化合价的氮元素的物质,A、B分别代表两种含不同化合价的氯元素的物质(每种物质中,氮或氯元素的化合价只有一种),又知物质M中的氮元素的化合价要比物质Q中氮元素的化合价要低。在一定条件下,它们会发生如下的转化(关系式未配平)
①P+A→ Q+B ②L+O2 → M+H2O ③L+M→ R+H2O
④B+H2O →A+O2
(1)若五种含氮元素的物质中,有一种是硝酸,则硝酸是 ,理由是 。
(2)反应必须在催化剂(铂、氧化铁)等作用下,加热到一定温度时方能发生,此反应在化工生产上有重要用途。据此推断在同温同压下,若物质R的密度比二氧化碳密度小,则R的化学式为 。
(3)某学生写出下面三个含氮的物质的相互转化关系式
(a)M+P→N2O3 + H2O (b)N2O4 + H2O→P+Q (c)M+L→Q+H2O
其中一定不能实现的是 ,理由是 。
22.下列反应可用于检查司机是否酒后开车:
(1)配平下列反应的化学方程式
K2Cr2O7 + C2H5OH + H2SO4 → Cr2(SO4)3+ CH3COOH + K2SO4+
(橙红色) (绿色)
(2)若司机酒后开车,则显示 色。
(3)反应中铬元素的化合价从 价变为 价。
(4)如果反应中生成1 mol Cr3+离子,转移的电子总数约为 个。
21.已知NaBiO3不溶于水,它与硫酸酸化的MnSO4稀溶液反应如下,配平此离子方程式:
NaBiO3 + Mn2++ H+→ Bi3++ Na++ MnO4-+ H2O
若消耗0.10molNaBiO3,则硫酸的消耗量为 mol,该反应的化学方程式为 。
20.1986年,化学上第一次用非电解法制得氟气,试配平该反应的化学方程式:

反应中____________元素被还原。
19.长期以来一直认为氟的含氧酸不存在。自1971年美国科学家用F2通过细冰末获得HFO(次氟酸)以来,人们对HFO的研究引起了充分重视。
① HFO的电子式为________________
② 次氟酸能与水反应得到溶液A,A中含有B、C二种溶质。B常用于雕刻玻璃,C在二氧化锰催化作用下能迅速分解生成一种能使带火星木条复燃的气体。次氟酸与水反应的化学方程式为:_____________________________________________________。
③ 将A溶液滴入紫色酸性高锰酸钾溶液中,溶液紫色逐渐褪去。完成并配平此离子方程式:
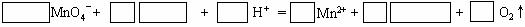
18.NaBH4中氢元素为-1价,它在水中电离形式为:NaBH4=Na++BH4-。该物质被有机化学家称为“万能还原剂”。
(1) NaBH4可用下列反应制得,试配平该化学方程式:
Na2B4O7+ Na+ H2+ SiO2→ NaBH4 + Na2SiO3
(2) NaBH4溶于水能生成H2、NaBO2,试写出有关的离子方程式 ;
氧化产物为 ;还原产物为 。
(3)NaBH4的重要用途之一是用来生成保险粉(主要成分为Na2S2O4)。试写出用NaBH4跟NaHSO3溶液反应生成Na2S2O4的化学方程式(产物中还有NaBO3) 。
17.某单质与过量的浓硝酸反应,参加反应的单质与硝酸的物质的量之比为4∶1,且硝酸的还原产物为NO2 ,则该单质的氧化产物中,组成该单质的元素化合价为 。
16.R2O8n- 在一定条件下可以把Mn2+氧化为MnO4- 。若反应的结果使R2O8n-转化成RO42- ,又知反应中氧化剂与还原剂的物质的量之比为5∶2。
(1)n值为 ;(2)R2O8n-中氧的化合价为 。
15.取1 mol硫化氢,完全燃烧生成液态水,放出热量为Q1;不完全燃烧生成气态水和硫,放出热量为Q2;不完全燃烧生成液态水和硫,放出热量为Q3。则下列关系正确的是 ( )
A.Q1>Q3>Q2 B.Q1>Q2>Q3
C.Q2>Q1>Q3 D.Q3>Q2>Q1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com