
题目列表(包括答案和解析)
24、(14分)取3.40g只含羟基、不含其它官能团的液态饱和多元醇,置于5.00L氧中,经点燃,醇完全燃烧。反应后气体体积减少0.56L。将气体经CaO吸收,体积又减少2.80L,(所有体积均在标准状况下测定)。
⑴(9分)3.40g醇中C、H、O物质的量分别为:C mol、H mol、O mol;该醇中C、H、O的原子数之比为 。
⑵(3分)由以上比值能否确定该醇的分子式? 。其原因是: 。
⑶(2分)如果将该多元醇的任意一个羟基换成一个卤原子,所得到的卤代物都只有一种,试写出该饱和多元醇 的结构简式。
试测题答案及评分标准
第Ⅰ卷
23、(3分)请模仿上题,写出下列3个反应的产物(不必写中间体),反应是不可逆的。
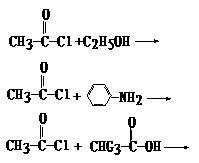
22、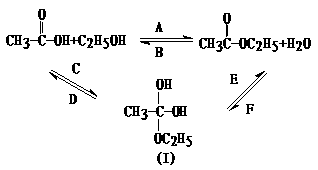 (8分)乙酸跟乙醇在浓硫酸存在并加热和条件下发生的酯化反应(反应A),其逆反应是水解反应(反应B)。反应可能经历了生成中间体(Ⅰ)这一步
(8分)乙酸跟乙醇在浓硫酸存在并加热和条件下发生的酯化反应(反应A),其逆反应是水解反应(反应B)。反应可能经历了生成中间体(Ⅰ)这一步
⑴(3分)如果将反应按加成、消去、取代反应分类,则A-F个反应中(将字母代号填入下列空格中),属于取代反应的是 ;属于加成反应的是 ;属于消去反应的是 。
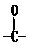
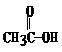 ⑵(3分)如果使原料C2H5OH,用
⑵(3分)如果使原料C2H5OH,用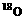 标记,则生成物乙酸乙酯中是否有
标记,则生成物乙酸乙酯中是否有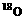 ?如果使原
?如果使原
料
中羰基( )或羟基中的氧原子用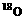 标记,则生成物H2O中氧原子是否有
标记,则生成物H2O中氧原子是否有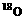 ?试简述你判断的理由。
?试简述你判断的理由。
⑶(2分)在画有圈号的3 个碳原子中,哪一个(或哪些)碳原子的立体形象更接近甲烷分子中的碳原子?试述其理由。
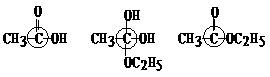
21、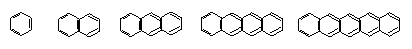 (11分)下面是苯和一组稠环芳香烃的结构式
(11分)下面是苯和一组稠环芳香烃的结构式
……
①苯 ②萘 ③蒽 ④并四苯 ⑤并五苯 并m苯
⑴(4分)写出化合物②-⑤的分子式:①C6H6 ② ③ ④ ⑤
⑵(4分)这级化合物的分子式通式是C H (请以含m的表示式填在横线上,m=1,2,3,4,5……)
⑶(3分)由于取代基的位置不同而产物的异构现象,称为官能团位置异构,一氯并五苯有 (填数字)个异构体,二氯蒽在 (填数字)个异构体。
20、(10分)120℃、101.3KPa条件下,有2LH2O、2LCO、1LCO2、0.5LO2和1LH2组成的混合气体。将混合气体通过分别放有足量Cu粉、C粉和CuO粉的三个灼热的反应管。假设气体通过每个反应管都能充分反应,且不论三个反应管以何种顺序排列,问:
⑴尾气是否有可能是单一气体? (填“可能”或“不可能”)。若可能,该气体是
⑵原气体中是否有几种(或一种),不可能再存在于尾气之中: (填“有”或“没有”。若有,它们(或它)是 。
⑶原气体中是否有几种(或一种)肯定存在于尾气中? (填“有”或“没有”。若有,它们(或它)是 。
19、(6分)今用铝、稀硫酸和氢氧化钠溶液为原料,实验室制备一定量的氢氧化铝。分别采用如下化学方程式所表示的两种方法:①2Al+3H2SO4=Al2(SO4)3+H2↑Al2(SO4)3+6NaOH=2Al(OH)3↓+3Na2SO4 ②2Al+2NaOH+2H2O=2NaAlO2+3H2↑2NaAlO2+H2SO4+2H2O=2Al(OH)3↓+Na2SO4
⑴请问上述哪一种方法比较节约试剂?(提示:试从每生产2molAl(OH)3所耗费的试剂用量予以说明。)
⑵原料相同,请设计一种更为节约试剂的方法(以方程式表示,并说明其可以最节约试剂的根据)。
18、(4分)3.2g铜与过量硝酸(8mol·L-1 、30mL)充分反应,硝酸的还原产物有NO2和NO。反应后溶液中所含H+为amol,则此进溶液中所含NO3-为 mol。
17、工业制纯碱时,第一步是通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠结晶,它的反应原理可以用下面的方程式表示:NH3+CO2+H2O=NH4HCO3
NH4HCO3+NaCl(饱和)=NaHCO3↓+NH4Cl
以上反应的总结果是放热反应。请设计一个实验:用最简单的实验装置模拟实现这一过程,获得碳酸氢钠结晶。可供选择的实验用品有:6 mol·L-1盐酸,6mol·L-1硫酸,浓氨水,氢氧化钠、消石灰、石灰石、氯化铵、食盐、蒸馏水和冰,以及中学化学实验常用仪器。
⑴画出实验装置示意图(包括反应时容器中的物质),并用图中玻璃容器旁自基至右分别用A、B、C……符号标明(请见题后说明)
⑵请写出在图上用A、B、C……各玻璃容器中盛放物质的化学式或名称。A:
B: C: D: E:
⑶利用在本题所提供的实验用品,如何判断得到的产品是碳酸氢钠的结晶,而不是碳酸氢铵或食盐结晶。 答:
说明:①本题装置示意图中的仪器可以用下面的方式表示。


敞口玻璃容器 有塞玻璃容器 玻璃漏斗 分液漏斗

 玻璃导管
(但应标示出在液面上或液面下)
玻璃导管
(但应标示出在液面上或液面下)
②铁架台、石棉网、酒精灯、玻璃导管之间的联接胶管等,在示意图中不必画出。如需加热,在需加热的仪器下方,标以“△”表示。
36.(12分)1996年诺贝尔化学奖授予对发现C60有重大贡献的三位科学家。C60分子是形如球状的多面体(如图),该结构的建立基于以下的考虑:
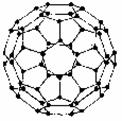
①C60分子中每个碳原子只跟相邻的3个碳原子形成化学键
②C60分子只含有五边形和六边形
③多面体的顶点数、面数和棱这数的关系,遵循欧拉定理:
顶点数 + 面数-棱边数 = 2
据上所述,可推知C60分子有12个五边形和20个六边形, C60分子所含的双键数为30。
请回答下列问题:
(1)固体C60与金刚石相比较,熔点较高者应是[答:金刚石],理由是[答:金刚石的晶体类型是原子晶体,而固体C60不属于原子晶体(实际上可以认为是分子晶体)]
(2)试估计C60跟F2在一定条件下能否发生反应生成C60F 60(填“可能”或“不可能”)[答:可能],并简述其理由[答:因C60分子中含有30个双键,与极活泼的F2发生加成反应可能生成C60F60]
(3)通过计算,确定C60分子所含单键数。
[解]:由欧拉定理计算键数为60+(12+20)-2=90,则分子中的单键数=90-30=60
(4) C70分子也已经制得,它的分子结构模型可以与C60同样考虑面推知。通过计算确定C70分子中五边形和六边形的数目。
[解]:设C70分子中的五边形的数目为x个,六边形的数目为y个,由题意可得方程组:
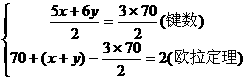 解得五边形的数目x=12,六边形的数目y=25
解得五边形的数目x=12,六边形的数目y=25
35.(6分)将8.8克FeS固体置于200毫升2.0摩/升的盐酸中,以制备H2S气体。反应完全后,若溶液中H2S的浓度为0.10摩/升,假定溶液体积不变,试计算: (1)收集到的H2S气体的体积(标准状况)。 (2)溶液中Fe2+和H+的物质量浓度(摩尔浓度)
[提示]:根据方程式FeS+2H+
= Fe2++H2S可判断盐酸过量,计算以FeS的物质的量为基准。FeS的物质的量=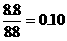 摩尔
(1)共生成H2S0.10摩尔,在溶液中溶解的物质的量为0.10×0.20=0.02摩尔,所以收集到H2S气体的物质的量=0.10-0.02=0.08摩尔,换算成体积=22.4×0.08=1.8升。
(2)生成Fe2+0.10摩尔,其浓度为
摩尔
(1)共生成H2S0.10摩尔,在溶液中溶解的物质的量为0.10×0.20=0.02摩尔,所以收集到H2S气体的物质的量=0.10-0.02=0.08摩尔,换算成体积=22.4×0.08=1.8升。
(2)生成Fe2+0.10摩尔,其浓度为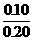 =0.5摩/升,消耗掉H+的物质的量为0.20摩尔。反应前H+的物质的量为2.0×0.2=0.4摩尔,故H+最后的浓度为
=0.5摩/升,消耗掉H+的物质的量为0.20摩尔。反应前H+的物质的量为2.0×0.2=0.4摩尔,故H+最后的浓度为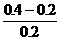 =1.0摩/升。
=1.0摩/升。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com