
题目列表(包括答案和解析)
21.(8分,每空2分)(1)2NH3  NH4+ + NH2- (2)AD (3)H2O;H2O
NH4+ + NH2- (2)AD (3)H2O;H2O
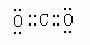
22(各2分)(1) Fe2O3 (2) ①③④
(3) Al(CH3)3 + 3H2O = 3CH4 ↑+ Al(OH)3 ↓ 2Al + 2OH- + 2H2O = 2AlO2- + 3H2 ↑
20.(12’)(1)分液漏斗;(1’) 浓盐酸(1’)
(2)2Cl2+2Ca(OH)2 =Ca(ClO)2+CaCl2+2H2O(2’)
(3)Cl2易腐蚀橡皮塞(2’)
(4)①将U型管置于冷水浴中(2’)
19. (8’) (1)ABD (4’) (2)①不漏气(1’) ②不能确定(1’);
不管装置是否漏气,烧瓶内气压与漏斗上方的气压相等,水在重力作用下可完全流入。(2’)
26.(10分)HNO3是极其重要的化工原料,在工业、农业、医药、军事等领域有着广泛的应用。现代工业上制备HNO3通常采用NH3催化氧化法,原料主要是氨气和氧气。这个方法的生产过程大致可分为三个阶段:氨催化氧化生成NO;NO氧化生成NO2,NO2被水吸收生成HNO3和NO,NO反复循环使用可完全转化为HNO3;尾气的处理。
问题1:由于二氧化氮不能被水完全吸收,因此生成的气体须经过多次氧化、吸收的循环操作,使其充分转化为硝酸(如果不考虑生产过程中的其它损失)。
(1)从理论上分析,要使氨气完全转化为硝酸,则原料氨气和氧气的投料比至少为 ;
(2)如果按理论上的投料比将原料放在一个具有反应条件的密闭容器中进行,所有物质不与外界交换,则最后所得溶液的质量分数为 ;
(3)循环操作的次数与NO2→HNO3的转化率具有一定的数学关系。计算一定量的二氧化氮气体大约要经过 次循环操作,才能使二氧化氮的转化率达到95%。
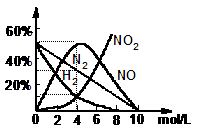 问题2:将上述方法制备的HNO3用水稀释或蒸馏浓缩可制得不同浓度的HNO3。实验证明:不同浓度的HNO3与同一金属反应可生成不同的还原产物。例如,镁与硝酸反应实验中,测得其气体产物有H2、N2、NO、NO2,溶液中产物有Mg(NO3)2,NH4NO3和H2O。
问题2:将上述方法制备的HNO3用水稀释或蒸馏浓缩可制得不同浓度的HNO3。实验证明:不同浓度的HNO3与同一金属反应可生成不同的还原产物。例如,镁与硝酸反应实验中,测得其气体产物有H2、N2、NO、NO2,溶液中产物有Mg(NO3)2,NH4NO3和H2O。
生成这些产物的HNO3浓度范围见下表。
|
生成产物 |
H2 |
N2和NH4+ |
NO |
NO2 |
|
c(HNO3)mol/L |
c<6.6 |
c<10 |
0.1<c<10 |
c>0.1 |
各气体产物成分及含量随HNO3浓度变化曲线如右图所示。
(4)将3gMg投入400mL11mol/L的HNO3中,充分反应后硝酸的浓度约为 得到的还原产物有 ;
(5)960 mg Mg与足量 4mol/L的HNO3完全反应,收集到224 mL(S.T.P)气体,则生成硝酸铵的物质的量为 ,试通过计算写出此过程中反应的总反应方程式。
。
江苏省如皋中学高三理科实验班化学高考强化模拟卷(2)
25.(10分)某研究性学习小组拟用铜屑与氧化铜混合物与硫酸和硝酸组成的混酸反应来制取CuSO4·5H2O晶体,混酸中硝酸的还原产物为NO,反应过程中不产生SO2,反应后的溶液中不含Cu(NO3)2, 反应中固体完全溶解,两种酸均恰好完全反应。设固体混合物的总质量为480 g,其中铜的质量分数为x,试回答下列。
(1)所得硫酸铜晶体的质量y为: g(用x表示);
(2)若x =0.4,混酸中HNO3与H2SO4的物质的量之比为: ;
(3)若x=0.4,480g固体混合物与一定量混酸微热后,充分反应,冷却恰好只得到CuSO4·5H2O,试求原混酸中H2SO4的质量分数。
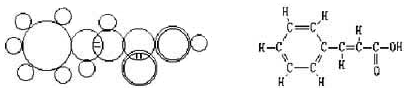
24.(10分)今年是杰出的奥地利化学家约瑟夫·劳施密特(Josef Loschmidt)逝世110周年,1861年他著的《化学研究》第一卷中就有如下左图物质圈图,即肉桂酸结构(如右侧图)
肉桂酸的合成路线如下:
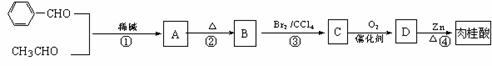
 已知:
已知:
①
②

试回答下列:
(1)D的结构简式为: 。
(2)属于消去反应的有: (填序号)
(3)与肉桂酸互为同分异构体且能使溴的四氯化碳溶液褪色还能与碳酸氢钠溶液反应的
异构体有: 、 、 、 。
(4)肉桂酸苄酯是一种重要的定香剂,是由肉桂酸与苯甲醇反应得到的,写出该反应的
化学方程式: 。
23.(8分)原子核磁共振谱(PMR)是研究有机化合物结构的重要方法之一。在所研究的化合物分子中,所处位置完全相同的氢原子(等性H原子)在核磁共振谱中出现同一种信号峰,谱中峰的强度与等性H原子的数目成正比。如 乙醛(CH3CHO)在核磁共振谱中有2种信号峰,其强度之比为3:1。
(1)结构简式如右图所示的有机物,在PMR谱中观察到各种峰
的强度之比为 ;
 (2)实践中可以根据PMR谱中观察到的氢原子给出的峰值情况,
(2)实践中可以根据PMR谱中观察到的氢原子给出的峰值情况,
确定有机物的结构。如化学式为C3H6O2的链状有机化合物,在
核磁共振谱上给出的峰的稳定强度仅有四种,其中的二种峰值
强度之比为 ① 3:3 ② 2:2:1:1 请推断出其对应的结构简式
① , ② ;
(3)如果用核磁共振谱的方法来研究C2H6O的结构。请简要说明根据核磁共振谱的结果来确定C2H6O分子结构的方法
。
22.(10分)已知固体甲、E、I、F均为常见的单质,其中E在常温下为气态。G为白色胶状沉淀,既能溶解于盐酸,又能溶解于氢氧化钠溶液。A在常温下为气态,与氧气完全反应时的体积比是1:2。W是由三种处在不同短周期的元素组成的化合物,与水反应生成A和G时的化学计量数之比为1:3:3:1。各物质有如下图所示的转化关系(部分反应的产物未全部表示)。试回答下列问题:
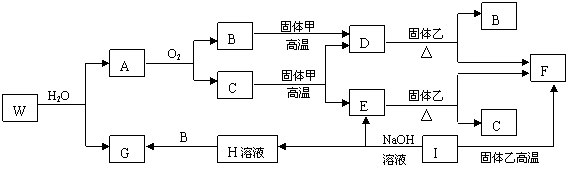

(1)B的电子式为 ,固体乙的化学式可能是 ;
(2)上述转化中,①C→E ②D→F ③E→F ④I→F ⑤I→E ⑥A→B 其中属于置换反应的是(填序号) ;
(3)写出W和水反应的化学方程式______________________________________________,
I和NaOH溶液反应的离子方程式__________________________________________。
21.(8分)人们对酸碱的认识,已有几百年的历史,经历了一个由浅入深、由低级到高级的认识过程。我们目前中学课本中的酸碱理论是1887年阿仑尼乌斯(Arrhenius)提出了的电离理论。
(1)1905年富兰克林(Franklin)深入研究了水和液氨的相似性,把阿仑尼乌斯以水为溶剂的个别现象,推到任何溶剂,提出了酸碱溶剂理论。溶剂理论认为:凡能离解而产生溶剂正离子的物质为酸,凡能离解而产生溶剂负离子的物质为碱。试写出液氨自身弱电离的方程式: 。
(2)1923年丹麦化学家布朗斯物(Brφusted)和英国化学家劳莱(Lowry)提出了质子论。凡是能够释放质子(氢离子)的任何含氢原子的分子或离子都是酸;凡是能与质子(氢离子)结合的分子或离子都是碱。
按质子理论:下列粒子在水溶液既可看作酸又可看作碱的是 。
A.H2O B.NH4+ C.OH- D.HCO3- E.CH3COO- F.Cl-
(3)1923年路易斯(Lewis)提出了广义的酸碱概念。凡是能给出电子对而用来形成化学键的物质是碱;凡是能和电子对结合的物质都是酸。如:
酸(电子对接受体) 碱(电子对给予体) 反应产物
H+
+
[∶OH ]-  H∶OH
H∶OH
试指出下列两个反应中的酸或碱
① H3BO3 + H2O H+ + B(OH)4- 该反应中的碱是 (填:H3BO3 或 H2O)
② NaH + H2O = NaOH +H2↑ 该反应中的酸是 (填:NaH 或 H2O)
20.某学生设计如下实验装置利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:

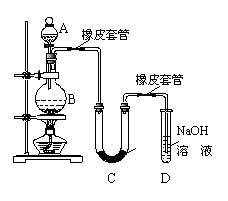 (1)A仪器的名称是
,所盛试剂
(1)A仪器的名称是
,所盛试剂
是 。
(2)漂白粉将在U型管中产生,其化学反应方程式是
。
(3)有同学建议在两个橡皮套管内的玻璃管口应尽量紧
靠,原因是 。
(4)此实验结果所得Ca(ClO)2产率太低。经分析并查阅资
料发现主要原因是在U型管中存在两个副反应:
①温度较高时氯气与消石灰反应生成了Ca(ClO3)2,为避免此副反应的发生,可采取的措施是 。
②试判断另一个副反应是(写出此反应方程式) 。
为避免此副反应发生,可采取的措施是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com