
题目列表(包括答案和解析)
2、下列说法或做法正确的是( )
A.硫酸钠是制玻璃和造纸的重要原料
B.重晶石用于制媒染剂和制白色颜料
C.98%的硫酸与纤维素混合后用水浴加热制取葡萄糖
D.浓硫酸洒在皮肤上先用水冲洗,然后用稀碳酸氢钠溶液中和
1、美国科学家发现的C60是一种新的分子,它具有空心的类似足球的结构,被称为“分子足球”。最近日本科学家确认世界还存在着另一种“分子足球N60”,它与C60的结构相似,并且在高温或机械撞击后,其中积蓄的巨大能量会在一瞬间释放出来,对于N60,下列说法中正确的是( )
A.N60是由共价键构成的空心圆球面结构,所以它是一种原子晶体
B.N60和14N都是氮的同位素 C.N60没有同素异形体
D.N60的发现开辟了能源世界新天地,将来会成为很好的火箭燃料
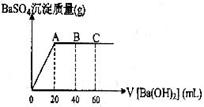
29.(5分)在t℃时,稀硫酸和盐酸混合液中,c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12.向20mL该混合酸溶液中逐滴加入Ph=11Ba(OH)2溶液,生成BaSO4的量如图所示,当加入60mL Ba(OH)2溶液时,C点溶液的pH=6(体积变化忽略不计),试计算:
(1)最初混合酸溶液中c(H2SO4)= ,c(HCl)= ;
(2)A点pH= ;
(3)B点比最初混合酸的pH增加多少(写出计算过程)?(lg3=0.48)
28. (4分)某a一氨基酸相对分子质量不超过200,已知该氨基酸含C、H、O、N四种元素,其中氮元素的质量分数约为9.27%,氧元素的质量分数约为21.19%,其分子结构中含苯环。该氨基酸的结构简式为
;如果由该氨基酸相互结合形成三肽,其相对分子质量约为
,其结构简式为
。
(4分)某a一氨基酸相对分子质量不超过200,已知该氨基酸含C、H、O、N四种元素,其中氮元素的质量分数约为9.27%,氧元素的质量分数约为21.19%,其分子结构中含苯环。该氨基酸的结构简式为
;如果由该氨基酸相互结合形成三肽,其相对分子质量约为
,其结构简式为
。
27.(8分)水杨酸是合成阿斯匹林的重要原料。水杨酸的学名邻羟基苯甲酸,结构简式为
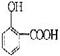 请回答下列问题:
请回答下列问题:
(1)请写出水杨酸中除苯环外具有的官能团 ;
(2)请写出与水杨酸互为同分异构体,既属于酚类又属于酯类化合物的结构简式:
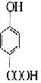 ;
;
(3)水杨酸的另一种同分异构体的结构简式为, 1mol该有机物在适宜条件下与
氢氧化钠经过一系列反应,最多能消耗氢氧化钠的物质的量为(填序号) ;
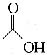 (A)1mol (B)
2mol
(C) 3mol (D) 4mol
(A)1mol (B)
2mol
(C) 3mol (D) 4mol
(4)已知有机物CH3COOH可以表示,在一定条件下,水杨酸与乙酸酐可合成
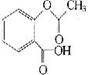
阿斯匹林,阿斯匹林可表示为: 则阿斯匹林的分子式为 ;
(5)阿斯匹林药片需要保存在干燥处,受潮的药片易变质不宜服用;检验受潮药片是否变质的试剂是(只选一种试剂即可) 。
26.(9分)已知卤代烃R-Cl在一定的条件下可以发生如下反应:
|
R-C+H2O--→R-OH+HCl
|
|
|
|
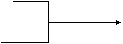
 A--→D----→E
A--→D----→E
|
|
CH2=CH2 --→B----→F
|
(1)若乙为氯化氢,则G的结构简式为 ;
若乙为氯气,则G的结构简式可能为
。
(2)请填写①②③的反应类型(填序号)
① ② ③ ;
(A)取代反应 (B)加成反应 (C)氧化反应 (D)还原反应 (E)加聚反应 (F)缩聚反应 (G)消去反应
D→E: ;
CH2=CH2→C: ;
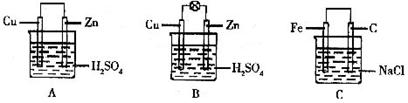
25.(8分)(1)把一块纯净的锌片插入装有稀硫酸的烧杯里,可观察到锌片上有气泡,再平行插入一块铜片,可观察到铜片 (填“有”或“没有”)气泡产生。再用导线把锌片和铜片连接起来(见下图A),组成一个原电池,负极为 ,正极的电极反应式为 。
(2)如果烧杯中最初装入的是2mol·L-1 500mL的稀硫酸溶液,构成铜锌原电池(见下图B,假设产生的气体没有损失),当在标准状况下收集到11.2L的氢气时,则此时烧杯内溶液中溶质的物质的量浓度应为(溶液体积变化忽略不计)
。
(3)如果电极材料分别是铁片和石黑并进行连接,插入氯化钠溶液中(见下图C),放置数天后,主要发生 电化学腐蚀,写出正极的电极反应式
。
(4)生活中利用原池原理生产了各样的电池,废电池必须进行集中处理的问题已被提到议事日程,其最主要原因是 。
(A)回收利用电池外壳的金属
(B)防止电池中汞、镉和铅等重金属离子对土壤、水源的污染
(C)防止电池中渗泄的电解液腐蚀其他物品
(D)回收其中的石墨电极
24.(7分)在80℃时,将0.20mol的四氧化二氮气体充入1L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
|
时间(s) 浓度(mol·L-1) |
0 |
20 |
40 |
60 |
80 |
100 |
|
c(N2O4) |
0.20 |
C1 |
0.10 |
C3 |
A |
B |
|
c(NO2) |
0.00 |
0.12 |
C2 |
0.22 |
0.22 |
0.22 |
根据本题内容和表格中提供的数据填空(C1、C2、C3、A、B表示相应的浓度)请回答下列各小题:
(1)该反应的化学方程式为 ;达到平衡时四氧化二氮的转化率为 %,表中C2 C3 A (填“<”、“>”)
(2)20s时,四氧化二氮的浓度C1= mol·L-1,在s~20s内四氧化二氮的平均反应速率为 。
(3)若在相同情况下是初向该容器充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的起始浓度是 mol·L-1。
23.(5分)(1)在25℃条件下将Ph=3的醋酸溶液稀释100倍,稀释后溶液的pH为(填序号) 。
(A)3 (B)5 (C)2~3之间 (D)3~5之间
(2)25℃时,向0.1mol·L-1的醋酸溶液中加入少量醋酸钠晶体,当晶体溶解后测得溶液pH增大,主要原因是(填序号)
(A)醋酸与醋酸钠发生化学反应
(B)醋酸钠溶液水解显碱性,增加了c(OH-)
(C)醋酸钠溶于水,电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小
(3)室温下,如果将0.1molCH3COONa和0.05 mol HCl全部溶于水,形成1L混合溶液(假设无损失),请写出溶液中存在平衡的电离方程式和离子方程式 。
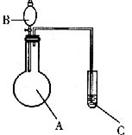
22.(7分)拟用下图装置和表中所列试剂进行实验并得出实验结论 (图中铁架台、铁夹、加热装置等已略去;必要时可以加热;A、B、C表示相应仪器中加入的试剂)。
|
序号 |
A |
B |
C |
C中现象 |
实验结论 |
|
① |
碳酸钠 |
醋酸溶液 |
苯酚钠溶液 |
溶液变浑浊 |
酸性:醋酸>碳酸>苯酚 |
|
② |
无水乙醇 |
浓硫酸 |
溴水 |
溴水褪色 |
证明乙烯有碳碳不饱和键可与溴发生加成反应 |
请回答下列问题:
(1)上述实验和结论一定正确的是(填序号) 。
(2)如果你为上述实验和结论有不合理的,请写出序号并说明理由:
(3)请你用上述装置设计一个实验,选择试剂、简述C中的现象并根据实验现象得出实验结论:
所选试剂:A: B: C: ;
C中的现象: ;
实验结论: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com