
题目列表(包括答案和解析)
5. 毒气沙林的主要成份甲氟磷酸异丙酯的结构为F-P-O-CH
毒气沙林的主要成份甲氟磷酸异丙酯的结构为F-P-O-CH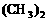 ,消除环境的沙林
,消除环境的沙林
CH3
毒气最好喷洒
(A)食盐水 (B)稀盐酸 (C)酒精 (D)肥皂水
|
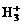 离子,其构型为等边三角型,属于二电子三中心离子。同时
离子,其构型为等边三角型,属于二电子三中心离子。同时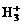 和氢分子可进一步形成
和氢分子可进一步形成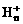 。有关判断正确的是
。有关判断正确的是
(A)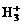 的电子式为
的电子式为
(B)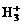 可进行反应,在液态氢中形成
可进行反应,在液态氢中形成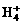 、
、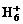 、
、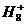
(C)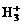 可在液态氢中形成
可在液态氢中形成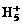 、
、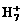 、
、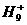 (D)
(D)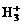 广泛存在于固态、液态和气态氢中
广泛存在于固态、液态和气态氢中
4.2000年5月,保利集团在香港拍卖会上花费3000多万港币购回在火烧圆明园时流失的国宝:铜铸的牛首、猴首和虎首。普通铜器时间稍久容易出现铜绿,其主要成分是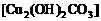 。这三件1760年铜铸的国宝在240年后看上去仍然熠熠生辉不生锈,下列对其原因的分析,最可能的是
。这三件1760年铜铸的国宝在240年后看上去仍然熠熠生辉不生锈,下列对其原因的分析,最可能的是
(A)它们的表面都电镀上一层耐腐蚀的黄金
(B)环境污染日趋严重,它们表面的铜绿被酸雨溶解洗去
(C)铜的金属活动性比氢小,因此不易被氧化
(D)它们是含一定比例金、银、锡、锌的铜合金
3.在星际云中发现一种高对称的有机分子,据分析,该有机分子含碳、氢氮三种原子,分子内有四个氮原子,且4个氮原子排列成四面体,每两个氮原子间都有一个碳原子,且分子内无碳碳单键和碳碳双键,该化合物的分子式为:
A C3H8N4 B C6H12N4 C C6H10N4 D C4H8N4
2.纳米是长度单位,1纳米等于1×10-9米,物质的颗粒达到纳米级时,具有特殊的性质。例如将单质铜制成“纳米铜”时,具有非常强的化学活性,在空气中可以燃烧。下列对“纳米铜”的有关叙述正确的是
A 常温下“纳米铜”比铜片的金属性强 B 常温下,“纳米铜”比铜片更易失电子
C 常温下,“纳米铜”与铜片的还原性相同 D 常温下,“纳米铜”比铜片的氧化性强
1.日本的白川英树、美国的马克迪尔米德和艾伦·黑格尔,由于发现了渗杂聚乙炔具有
良好导电性,因而共同成为2000年诺贝尔化学奖得主,那么关于聚乙炔的以下叙述错误的是:
A 单体为不饱和烃 B 聚乙炔的分子中含有碳碳双键
C 聚乙炔的式量为26 D 聚乙炔中,碳的质量分数为92.3%
26.(10分)现有Fe、Cu组成的合金,其中Fe、Cu的总物质的量为a mol,Cu的物质的量分数 为x;研成粉末后,全部投人含b mol HNO3的稀溶液中,微热使其充分反应,且硝酸的还原产物只有NO,试回答下列问题:
(1) 用微粒符号填写下列空白。(列举出全部可能的情况)
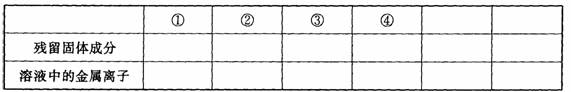
(2)当溶液中金属离子只有Fe2+、Cu2+时,则b的取值范围是:
(用a, x表示)__________________。
(3) x=0.5 时 ,溶液中Fe2+、Fe3+的物质的量相等时,在标准状况下共产生672 mL气体。
求a, b的值。
25.(8分)超微小氮化铝粉末被广泛应用于大规模集成电路生产等领域。其制取原理为:
Al2O3+N2+ 3C 2AlN + 3C0,由于反应不完全,氮化铝产品中往往含有碳和氧化铝杂质。为
测定该产品中有关成份的含量,进行了以下两个实验:
2AlN + 3C0,由于反应不完全,氮化铝产品中往往含有碳和氧化铝杂质。为
测定该产品中有关成份的含量,进行了以下两个实验:
(1) 10.00 g样品,将其加入过量的NaOH浓溶液中共热并蒸干,AlN跟NaOH溶液反应生成NaAlO2,并放出氨气3.36 L(标准状况)。
①上述反应的化学方程式为__________________
②该样品中的AlN的质量分数为____________________
(2)另取10.00 g样品置于反应器中,通人2.016 L(标准状况)O2,在高温下充分反应后测得气体的密度为1.34g·L-1(已折算成标准状况,AlN不跟O2反应)。该样品中含杂质碳的质量分数为______________________.
24.(14分)已知:a 1,3一丁二烯(H2C═CH─CH═CH2)与Cl2加成时可发生在1,2位和1,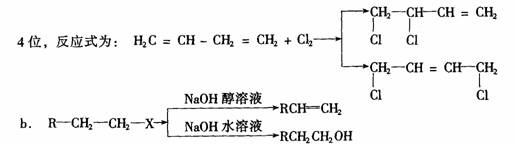
利用上述信息按以下步骤从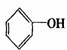 合成
合成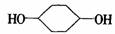 (部分试剂和反应条件已略去)
(部分试剂和反应条件已略去)

(1)分别写出A、C的结构简式:
A:___C:____。
(2)如果不考虑⑥、⑦反应,对于反应⑤得到的D的可能结构简式为____
(3)写出反应②、⑦的化学方程式:___________________
23.(6分)如果定义有机物的“同系列”是一系列结构式符合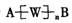 (其中n=1、2…)的化合物。其中A、B为任意的一种基团或原子,W为二价的有机基团,又称同系列的系差。
环氧乙烷
(其中n=1、2…)的化合物。其中A、B为任意的一种基团或原子,W为二价的有机基团,又称同系列的系差。
环氧乙烷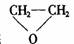 与乙二醇作用,控制一定的反应条件和反应物的用量,可生成一系列的双官能团的化合物,称为多缩乙二醇醚。其反应原理可表示为:
与乙二醇作用,控制一定的反应条件和反应物的用量,可生成一系列的双官能团的化合物,称为多缩乙二醇醚。其反应原理可表示为:
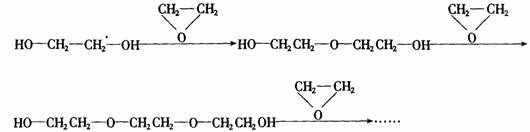
(1)以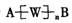 的形式表示上述一系列醇醚的结构简式________。
的形式表示上述一系列醇醚的结构简式________。
(2)写出上述同系列的分子式通式____________。
(3)推算出该同系列化合物中碳元素的质量分数最大值为________。
22.(12分)下图是中学化学中常见的物质间化学反应关系图示,其中未注明用量的物质间的反应均按恰好充分反应处理,其他有关信息已在框图中说明:

(1)写出下列物质的化学式:
A:_____、C:____、D:____、E:_____、F:______
G:____
(2)写出下列反应的化学方程式:
A→D气体:___________________________。
(3)白色固体B的化学式是否能确定?______。理由是___________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com