
题目列表(包括答案和解析)
3、能与铝作用放出H2的溶液中,可以大量共存的离子组是
A、NH4+、Mg2+、SO42-、Cl- B、Cu2+、Na+、HCO3-、Br-
C、Na+、Ba2+、NH4+、NO3- D、K+、Na+、AlO2-、Cl-
2、下列说法或做法正确的是
A、医生可用三氯化铁溶液作止血剂,原理是电解质使胶体凝聚
B、在蛋白质溶液里加入饱和硫酸铵溶液,可使蛋白质变性
C、用98%的硫酸与纤维素混合后,水浴加热来制取葡萄糖
D、用碱式滴定管盛装高锰酸钾溶液
1、有关胶体的说法中,正确的是
A、胶体都是均匀透明的液体
B、胶体溶液的电泳现象,证明胶体带有电荷
C、胶体产生丁达尔现象是由胶粒的大小决定的
D、胶粒能透过半透膜,所以可用渗析法提纯胶体
24.有机物X由C、H、O三种元素组成,X的沸点是198℃,已知:①在一定温度和压强下,在密闭容器中把4.2 L X蒸气和16.0 L O2混合点燃,当充分反应后,将温度和压强恢复到原来状况,得混合气体A为26.5 L(已知在该实验状况下气体的摩尔体积为42.0 L·mol-1);②当A处于标准状况下时,气体体积变为7.3 L,此时测得气体对H2的相对密度为19.64。解答下列问题:
(1)推断气体A的组成(简述过程和结论)。
(2)计算A的各组分的物质的量。
(3)确定X的分子式和结构简式。
23.取0.04mol KMnO4固体加热一段时间后,收集到a mol气体,此时KMnO4的分解率为X,在反应后的残留固体中加入一定量的浓盐酸,又收集到b mol气体,设此时Mn元素全部以Mn2+存在于溶液中,则:
(1)a+b=_________________(用X表示)
(2)当X=___________时,(a+b)取最小值,且最小值为 。
(3)当a+b=0.09mol时,0.04 mol KMnO4加热后所得固体残余物各是什么物质?其物质的量分别是多少?
22. 某液态有机物A6.2 克与足量镁粉反应,生成2.24 升H2(标准状态下),A与Na2CO3溶液不反应;在同温同压下测得A气体的密度为CO2气体密度的1.41倍。A分子内脱水可得B,A分子间脱水可得C或D。A氧化得E,E再氧化得F。A与F脱水可得G或H。
(1) 推断、写出结构简式:A______________C______________D_______________。
(2) 写出A与F分子间脱水的化学方程式.
_____________________________________________
21.据报道,最近有人第一次人工合成了一种有抗癌活性的化合物Depudecin,这种物质曾从真菌里分离出来,其结构如下:
(1)试写出这种化合物的化学式 ;
(2)该物质可能发生的反应有________;
A、加成 B、氧化 C、水解 D、酯化
(3)该物质可以称为_________;
A、烃类 B、烯烃 C、烃的衍生物 D、醇类
(4)若分子中一个碳原子连着四个不同的原子或原子团称不对称碳原子,请在结构简式上用*号标出不对称碳原子。
(5)如果一个不对称碳原子都可以出现两个光学异构体,则这种抗癌分子有 _________种不同的光学异构体。
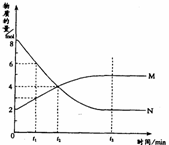
20、在恒定压强下,容器内某一反应中M、N两种气体的物质的量随反应时间变化的曲线如图,且已知在反应达到平衡时,体系的体积有所增加。请填写下列空格:
(1)该反应的化学方程式为:
_____________________________________;
(2)该反应的平衡常数表达式K=___________;该反应的K值随温度的升高而________(填增大、减少或不变),理由是________________________________。
(3)t1时,正反应速率______逆反应速率,t2时,正反应速率_______逆反应速率,t3时,正反应速率_______逆反应速率(填<、>或=);
(4)该反应在_______时刻到达平衡;
(5)达到平衡后,如果再加压,平衡______________移动(填“正方向”“逆方向”或“不”)。
19.查看下列数据,
|
|
乙醇 |
乙烷 |
氯乙烷 |
氯化钠 |
二氧化硅 |
|
熔点 |
-117.3℃ |
-183.3℃ |
-136.4℃ |
801℃ |
1723℃ |
|
沸点 |
78.5℃ |
-88.6℃ |
12.3℃ |
1465℃ |
2230℃ |
(1)一般来说,决定组成与结构相似的分子晶体的熔沸点的主要因素是______________________________;
(2)按照以上规律,无法解释乙醇与乙烷、氯乙烷之间熔点与沸点的大小的关系,可能原因是____________________________;
(3)氯化钠的熔沸点比较高的原因是__________________________;二氧化硅的熔沸点很高的原因是____________________。
18.不同元素的原子在分子内吸引电子的能力大小可用一定数值x来表示,若x越大,其原子吸引电子能力越强,在所形成的分子中成为带负电荷的一方。
下面是某些短周期元素的x值:
|
元素符号 |
Li |
Be |
B |
C |
O |
F |
Na |
Al |
Si |
P |
S |
Cl |
|
x值 |
0.98 |
1.57 |
2.04 |
2.55 |
3.44 |
3.98 |
0.93 |
1.61 |
1.90 |
2.19 |
2.58 |
3.16 |
⑴通过分析x值变化规律,确定N、Mg的x值范围:
_______<x(Mg)<____________,_________<x(N)<_____。
⑵推测x值与原子半径关系是 ____________________________ 。
根据短周期元素的x值变化特点,体现了元素性质的 变化规律。
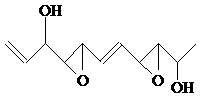
⑶某有机化合物结构式为:其中S-N中,你认为共用电子对偏向谁?
(写原子名称)。
⑷经验规律告诉我们:当成键的两原子相应元素的x差值(Δx)即Δx>1.7时,一般为离子键,Δx<1.7,一般为共价键,试推断:AlBr3中化学键类型是 。
⑸预测元素周期表中,x值最小的元素的位置: (放射性元素除外)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com