
题目列表(包括答案和解析)
22、(10分)常温下,A、B、C、D为四种气体单质。在一定条件下,B可以分别和
A、C、D化合生成甲、乙、丙。C和D化合可生成丁。已知甲、乙、丙每个分子含有的电子数相同,并且甲、乙、丙、丁如下关系
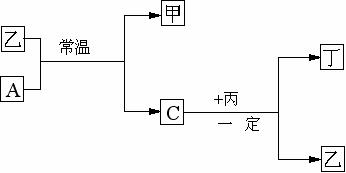
⑴单质B的分子式是 ,单质D的结构式是
⑵单质A跟化合物乙反应的化学方程式是
⑶单质C跟化合物丙反应的化学方程式是
⑷试根据化合物丙、丁中D元素的价态,判断丙和丁能否在一定条件下反应,若能反应,写出化学方程式 ,若不能反应,写出原因
。
21、⑴(5分)氮可以形成多种离子,如:N3-、N3-、NH4+、NH2-、N2H5+、N2H62+等,已知N2H5+和N2H62+由中性分子结合质子形成的,有类似于NH4+的性质,
①一个N3-含有 电子,
②写出形成N2H5+离子的电子式 ,
③写出N2H62+与足量的强碱溶液共热发生反应的离子方程式
④N2H5Cl溶于水后,溶液中c(OH-) c(H+),
⑵(4分)在人体的血液中,含有一定量的Na2CO3、NaHCO3,能保证血液的pH值变化不大,你分析它的原理可能是:(用离子反应方程式表示)
请你再举出一组类似的溶液:
20、(11分)实验室用稀硝酸与Cu反应来制备NO气体,如果采用(Ⅰ)装置,由于烧瓶内的空气不易排除,生成的NO很快被氧化成红棕色的NO2,不易观察到有无色的NO生成。既使可用排水法收集到无色的NO,也无说服力,会使人感到是NO2与H2O反应生成的。有人设计了(Ⅱ)装置,用来做该实验可以达到满意的效果。


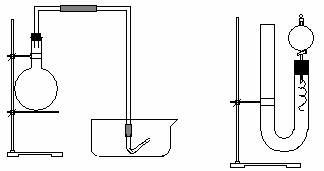
⑴将有关操作补充完全:
①将活塞打开,从U形管的长管口注入稀硝酸,一直注到 。
②关闭活塞,用酒精灯在 处加热,当 时,即停止加热。⑵回答下列问题
①写出铜与稀硝酸反应的离子方程式:
②反应在什么时候可以自动停止
在何处可以观察到无色的NO气体?
③如果再将分液漏斗活塞慢慢打开,可立即观察到哪些明显现象
④如果需要再获得NO与已生成的NO2形成鲜明的对照的实验效果,应
19、⑴(4分)下表是验证饱和氯水中所含主要微粒的实验操作和实验现象,请根据实验要求将相应的操作和现象的标号填写在答案栏:
|
A |
B |
C |
答案 |
||
|
氯水中的主要微粒 |
实验操作 |
实验现象 |
A |
B |
C |
|
a、H+ b、Cl- c、Cl2 d、HClO |
⑴将氯水滴入饱和的氢硫酸中 ⑵将氯水滴入品红溶液中 ⑶在氯水中滴加紫色石蕊试液 ⑷在氯水中滴加硝酸银溶液 ⑸将湿润的淀粉碘化钾试纸置于氯水试剂瓶口上方 |
①有白色沉淀生成 ②有淡黄色沉淀生成 ③白色变蓝色 ④红色变无色 ⑤滴入瞬间溶液显红色,随即又褪色 |
a |
|
|
|
b |
|
|
|||
|
c |
|
|
|||
|
d |
|
|
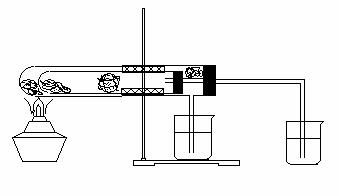
⑵(8分)下图为某学生设计的实验装置图,图中的大试管内装有干燥的碳酸钠,小试管内装有干燥的碳酸氢钠,A、B处均为沾有无水硫酸铜棉花,C、D处为澄清石灰水,请回答以下问题:
①用酒精灯加热时,A处的现象是: B处的现象是: ,C处的现象是 D处的现象是: 。②该实验证明了:
③教材中也有类似的实验,对比教材中的实验,该实验的好处是
④该实验图示中有一个明显的错误,请指出:
|
|
|
|
18、在一定温度下,向硫酸铜饱和溶液中加入无水硫酸铜,可以看到粉末由白色变成蓝色,则下列各量中不发生变化的是:
A、溶液质量 B、溶液中溶质的质量
C、溶液的pH值 D、溶液中溶质的质量分数
第Ⅱ卷(非选择题 共78分)
17、在常温时,将a1mlb1mol/LCH3COOH溶液加入到a2mlb2mol/LNaOH溶液中。下列结论中正确的是:
A、如果a1=a2、b1=b2,则混合溶液中c(CH3COO-)=c(Na+)
B、如果混合溶液的pH=7,则混合溶液中c(CH3COO-)=c(Na+)
C、如果混合溶液的pH>7,则a1b1=a2b2
D、如果a1=a2,且混合液的pH<7,则b1>b2
16、下列离子方程式书写正确的是:
A、标准状况下,2.24LCO2通入1molL-1100mlNaOH溶液中
CO2 + OH- = HCO3-
B、向漂白粉中通入适量的SO2气体
Ca2+ + 2ClO- + SO2 +H2O = CaSO3↓ + 2HClO
C、等物质的量的NH4HCO3与NaOH在溶液中反应
NH4+ +HCO3- + 2OH- = CO32- + NH3↑ + 2H2O
D、金属铁溶于盐酸中
2Fe + 6H+ = Fe3+ + 3H2↑
15、已知甲醛(HCHO)分子中4个原子是共平面的,下列分子中所有原子不可能存在于同一平面上的是:
A、苯乙烯 
B、苯甲酸 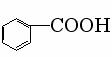
C、苯乙酮 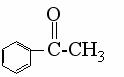
D、苯甲醛 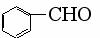
14、下列各组离子在指定的环境下能大量共存的是:
A、pH>7的溶液中,Na+、K+、S2-、MnO4-
B、pH=7的溶液中,Al3+、Cl-、NH4+、S2-
C、pH>7的溶液中,Na+、K+、AlO2-、NO3-
D、pH=0的溶液中,Fe2+、ClO-、NH4+、Na+
13、工业废气中氮的氧化物是重要的污染源,有一种治理的方法是通入适量的氨气将其还原为无毒物质N2和H2O,现有含氮氧化物NO和NO2的混合气体3L,用同条件下的NH33.5L恰好反应完全,则混合气体中NO和NO2的体积分数是:
A、1:4 B、1:3 C、1:2 D、1:1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com