
题目列表(包括答案和解析)
30.为了预防碘缺乏病,国家规定每千克食盐中应含有40-50毫克的碘酸钾。为检验某种食盐是否为加碘的合格食盐,某同学取食盐样品428克,设法溶解出其中全部的碘酸钾。将溶液酸化并加入足量的碘化钾淀粉溶液,溶液呈蓝色,再用0.030mol/L的硫代硫酸钠溶液滴定,用去18.00mL时蓝色刚好褪去。试通过计算说明该加碘食盐是否为合格产品。有关反应如下:
IO3-+5I-+6 H+→3I2+3H2O
I2+2S2O32-→2I-+S4O62-
29.为扩大现有资源的使用效率,在一些油品中加入降凝剂J,以降低其凝固点,扩大燃料油品的使用范围。J是一种高分子聚合物,它的合成路线可以设计如下,其中A的氧化产物不发生银镜反应:

试写出:
(l)反应类型;a 、b 、P
(2)结构简式;F 、H
(3)化学方程式:D→E
E+K→J
28.某有机物 A(C4H6O5)广泛存在于许多水果内,尤以苹果、葡萄、西瓜、山楂内为多。该化合物具有如下性质:
① 在25℃时,电离常数K1=3.99×10-4,K2=5.5×10-6
②A+RCOOH(或ROH) 有香味的产物
有香味的产物
③1molA 慢慢产生l.5mol气体
慢慢产生l.5mol气体
④A在一定温度下的脱水产物(不是环状化合物)可和溴水发生加成反应
试回答:(l)根据以上信息,对A的结构可作出的判断是 (多选扣分)
(a)肯定有碳碳双键 (b)有两个羧基
(c)肯定有羟基 (d)有-COOR官能团
(2)有机物A的结构简式(不含-CH3)为
(3)A在一定温度下的脱水产物和溴水反应的化学方程式:
(4)A的一个同类别的同分异构体是
27.利用天然气合成氨的工艺流程示意如下:

依据上述流程,完成下列填空:
(1)天然气脱硫时的化学方程式是
(2)n mol CH4经一次转化后产生CO 0.9n mol、产生H2 mol(用含n的代数式表示)
(3)K2CO3(aq)和 CO2反应在加压下进行,加压的理论依据是 (多选扣分)
(a)相似相溶原理 (b)勒沙特列原理 (c)酸碱中和原理
(4)由KHCO3分解得到的CO2可以用于 (写出CO2的一种重要用途)。
(5)整个流程有三处循环,一是Fe(OH)3循环,二是K2CO3(aq)循环,请在上述流程图中标出第三处循环(循环方向、循环物质)。
26.用实验确定某酸HA是弱电解质。两同学的方案是:
甲:① 称取一定质量的HA配制0.lmol/L的溶液100mL;
② 用pH试纸测出该溶液的pH值,即可证明HA是弱电解质。
乙:① 用已知物质的量浓度的HA溶液、盐酸,分别配制pH=l的两种酸溶液各100mL;
② 分别取这两种溶液各10mL,加水稀释为100mL;
③ 各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现 象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH 1(选填>、<、=)
乙方案中,说明HA是弱电解质的现象是 (多选扣分)
(a)装HCl溶液的试管中放出H2的速率快;
(b)装HA溶液的试管中放出H2的速率快;
(c)两个试管中产生气体速率一样快。
(3)请你评价:乙方案中难以实现之处和不妥之处 、
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述。
24.某化学反应2A B+D在四种不同条件下进行,B、D起始浓度为见反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为见反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
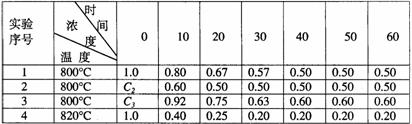
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为 mol/(L·min)。
(2)在实验2,A的初始浓度C2= mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为V3,实验1的反应速率为V1,则V3 V1(填>、=、<),且C3 1.0mol/L(填>、=、<)
(4)比较实验4和实验1,可推测该反应是 反应(选填吸热、放热)。理由是
23.化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如:

(l)在上述有编号的步骤中,需用还原剂的是 ,需用氧化剂的是 (填编号)。
(2)在上述循环中,既能与强酸反应又能与强碱反应的两性物质是 (填化学式)
(3)完成并配平步骤①的化学方程式,标出电子转移的方向和数目:
□Na2Cr2O7+□KI+□HCl→□CrCl3+□NaCl+□KCl+□I2+□
22.C8H18经多步裂化,最后完全转化为C4H8、C3H6、C2H4、C2H6、CH4五种气体的混合物。该混合物的平均相对分子质量可能是
A 28 B 30 C 38 D 40
第Ⅱ卷(共84分)
21.已知短周期元素的离子。aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是
A 原子半径 A>B>D>C B 原子序数 d>c>b>a
C 离子半径 C>D>B>A D 单质的还原性 A>B>D>C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com