
题目列表(包括答案和解析)
5.两次获得诺贝尔奖,在化学界享有盛名的科学家是
A 爱因斯坦 B 达尔文 C 居里夫人 D 欧拉
4.将饱和FeCl3溶液分别滴入下述液体中,能形成胶体的是
A 冷水 B 沸水 C NaOH浓溶液 D NaCl浓溶液
3.下列表达方式错误的是
A 甲烷的电子式 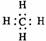
B 氟化钠的电子式 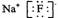
C 硫离子的核外电子排布式 1s22s22p63s23p4
D 碳-12原子 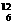 C
C
2.C60与现代足球 有很相似的结构,它与石墨互为
有很相似的结构,它与石墨互为
A 同位素 B 同素异形体 C 同分异构体 D 同系物
1.为维持人体内电解质平衡,人在大量出汗后应及时补充的离子是
A Mg2+ B Ca2+ C Na+ D Fe3+
31.合成氨原料可以由天然气制取。其主要反应为:CH4(g)+H2O(g)→CO(g)+3H2(g)
(1)1m3(标准状况)CH4按上式完全反应,产生H2 mol。
(2)CH4和O2的反应为:2CH4(g)+O2(g)→2CO(g)+4H2(g)
设CH4同时和H2O(g)及O2(g)反应。1m3(标准状况)CH4按上述两式完全反应,产物气体的体积V(标准状况)为 。
(3)CH4和H2O(g)及富氧空气(O2含量较高,不同富氧空气氧气含量不同)混合反应,产物气体组成如下表:
|
气体 |
CO |
H2 |
N2 |
O2 |
|
体积(L) |
25 |
60 |
15 |
2.5 |
计算该富氧空气中O2和N2的体积比V(O2)/V(N2)。
(4)若CH4和H2O(g)及富氧空气混合反应的产物中,V(H2)/V(N2)=3︰1 (合成氨反应的最佳比),则反应中的H2O(g)和富氧空气的体积比为何值?
30.超细氮化铝粉末被广泛应用于大规模集成电路生产等领域。其制取原理为:Al2O3+N2+3C 2AlN+3CO由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。为测定该产品中有关成分的含量,进行了以下两个实验:
2AlN+3CO由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。为测定该产品中有关成分的含量,进行了以下两个实验:
(1)称取10.00g样品,将其加入过量的NaOH浓溶液中共热并蒸干,AlN跟NaOH溶液反应生成NaAlO2,并放出氨气3.36L(标准状况)。
①上述反应的化学方程式为 ;
②该样品中的A1N的质量分数为 。
(2)另取10.00g样品置于反应器中,通入2.016L(标准状况)O2,在高温下充分反应后测得气体的密度为1.34g·L-1(已折算成标准状况,AIN不跟O2反应)。该样品中含杂质炭 g。
29.已知两个羧基之间在浓硫酸作用下脱去一分子水生成酸酐,如:


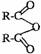 +H2O
+H2O
某酯类化合物A是广泛使用的塑料增塑剂。A在酸性条件下能够生成B、C、D。

(1)CH3COOOH称为过氧乙酸,写出它的一种用途 。
(2)写出B+E→CH3COOOH+H2O的化学方程式 。
(3)写出F可能的结构简式 。
(4)写出A的结构简式 。
(5)1摩尔C分别和足量的金属Na、NaOH反应,消耗Na与NaOH物质的量之比是 。
(6)写出D跟氢溴酸(用溴化钠和浓硫酸的混合物)加热反应的化学方程式:
。
28.自20世纪90年代以来,芳炔类大环化合物的研究发展十分迅速,具有不同分子结构和几何形状的这一类物质在高科技领域有着十分广泛的应用前景。合成芳炔类大环的一种方法是以苯乙炔(CH≡C- )为基本原料,经过反应得到一系列的芳炔类大环化合物,其结构为:
)为基本原料,经过反应得到一系列的芳炔类大环化合物,其结构为:

(1)上述系列中第1种物质的分子式为 。
(2)已知上述系列第1至第4种物质的分子直径在1-100nm之间,分别将它们溶解于有机溶刑中,形成的分散系为 。
(3)以苯乙炔为基本原料,经过一定反应而得到最终产物。假设反应过程中原料无损失,理论上消耗苯乙炔与所得芳炔类大环化合物的质量比为 。
(4)在实验中,制备上述系列化合物的原料苯乙炔可用苯乙烯(CH2=CH- )为起始物质,通过加成、消去反应制得。写出由苯乙烯制取苯乙炔的化学方程式(所需的无机试剂自选)
)为起始物质,通过加成、消去反应制得。写出由苯乙烯制取苯乙炔的化学方程式(所需的无机试剂自选)
27.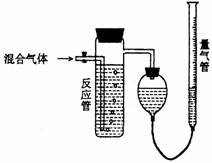 工业上测量SO2、N2、O2混合气体中SO2含量的装置如下图;反应管中装有碘的淀粉溶液。SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O→H2SO4+2HI
工业上测量SO2、N2、O2混合气体中SO2含量的装置如下图;反应管中装有碘的淀粉溶液。SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O→H2SO4+2HI
(1)混合气体进入反应管后,量气管内增加的水的体积等于 的体积(填写气体的分子式)。
(2)反应管内溶液蓝色消失卮,没有及时停止通气,则测得的SO2含量 (选填:偏高,偏低,不受影响)。
(3)反应管内的碘的淀粉溶液也可以用 代替(填写物质名称)。
(4若碘溶液体积为VamL.,浓度为Cmol·L-1,N2与O2的体积为VbmL(已折算为标准状况下的体积)。用C、Va、Vb表示SO2的体积百分含量为: 。
(5)将上述装置改为简易实验装置,除导管外,还需选用的仪器为. (选下列仪器的编号)。
a.烧杯 b.试管 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com