
题目列表(包括答案和解析)
32.(7分)向30.0 mL硫酸铜溶液中加入过量铝粉,待充分反应后,再向其中加人2.00mol·L-1烧碱溶液至沉淀不再减少,消耗烧碱溶液210 mL,且收集到气体0.672 L(标准状况)据此计算: (1)加入铝粉的质量. (2)原硫酸铜溶液的物质的量浓度.
31.(8分)已知: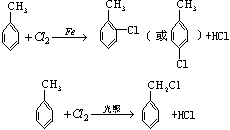
某有机物A 的分子量为198.5,A跟氯气反应,在铁粉存在下只有个1个氢原子被取代时能得到两种有机产物,而在光照下1个氢原子被取代时,只能得到一种有机产物;A跟NaHCO3反应,产生使石灰水变浑浊的无色气体;A在NaOH存在下水解后的溶液用硝酸酸化,再加入硝酸银溶液,会立即生成白色沉淀. A在一定条件下可发生一系列反应,最终生成D和F:

(1) 写出下列物质的结构简式:
A_______________________, C_______________________,
D_______________________, F_______________________.
(2) 指出下列反应的反应类型: A→B___________,C→D___________,C→E___________.
(3)E分子中所有碳原子是否可能在同一平面上___________(答“是”或“否”).
30.(10分)已知:①卤代烃在一定条件下能水解,如
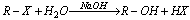 (R为烃基,X表示卤原子)
②有机物中的硝基在铁和盐酸作用下,能被还原成氨基:
R-NO2+3Fe+6HCl→R-NH2+3FeCl2+2H2O
对乙酰胺基酚又名扑热息痛,为白色晶体,是一种优良的解热镇痛药,其毒性较菲那西汀、阿司匹林低.扑热息痛的生产流程为:
(R为烃基,X表示卤原子)
②有机物中的硝基在铁和盐酸作用下,能被还原成氨基:
R-NO2+3Fe+6HCl→R-NH2+3FeCl2+2H2O
对乙酰胺基酚又名扑热息痛,为白色晶体,是一种优良的解热镇痛药,其毒性较菲那西汀、阿司匹林低.扑热息痛的生产流程为:
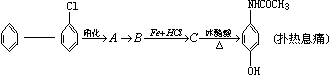
请回答下列问题: (1)写出反应的化学方程式
由氯苯制A:______________________________________
由A制B:_________________________________________
由B制C:_________________________________________
(2)扑热息痛在潮湿环境中长期受热能发生水解,写出扑热息痛水解的化学方程式:
(3)写出与扑息痛互为同分异构体、分子中含有苯环的氨基酸的结构简式.
29.(8分)A、B是中学化学里常用的物质,其中B是单质,A是化合物;他们之间相互反应以及生成物之间的转化关系如下图所示:
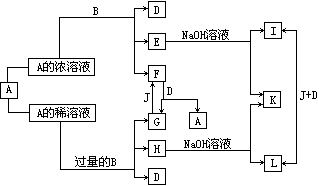
已知E溶液跟石炭酸的稀溶液混合时,溶液呈紫色.请回答: (1)B和A的浓溶液反应的条件是________________,而常温下难反应的原因是_________________________________________________________. (2)写出F和G相互转化的化学方程式: F → G_______________________________________; G → F_______________________________________. (3)L转化成I的现象是_______________________________________;有关的化学方程式是____________________________________.
28.(6分)已知25℃时0.l mol·L-1醋酸溶液的pH约为3.向其中加人少量醋酸钠晶体,待晶体溶解后发现溶液的pH增大.对上述现象有两种不同的解释:甲同学认为醋酸钠水解 呈碱性,增大了[OH-],因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离 子,抑制了醋酸的电离,使[H+]减小,因此溶液的 pH增大.你认为上述两种解释中__________(“甲”或“乙”)正确. (1)为了验证上述哪种解释正确,继续做如下实验:向 0.1 mol·L-1的醋酸溶液中加人少量下列物质________(填写编号),然后测定溶液的pH. (A)固体CH3COOK (B)固体CH3COONH4 (C)气体NH3. (D)固体NaHCO3 (2)若______(填“甲”或“乙”)的解释正确,溶液的pH应________(填“增大”、“减小”或“不变”). (已知:25℃时, 0.1 mol·L-1氨水的电高度为1.3%,0.1 mol·L-1醋酸的电离度为1.3%)
27.(10分)实验室可以用下图所示仪器连接起来制备纯净的二氧化碳并测定其式量.

现用含有少量硫化亚铁的大理石和盐酸反应制备二氧化碳气体,实验步骤如下: (1)将橡皮塞B塞在A烧瓶口,并用橡皮筋套在烧瓶的瓶颈处以标记橡皮塞所塞人瓶颈的深度,准确称其质量为m1g. (2)连接制备和净化气体的装置,其连接顺序是:___接___,___接___,___接___,___接___. (3)将导管G插入烧瓶A中用向______(填“上”或“下”)排空气法收集二氧化碳气体;检验二氧化碳气体已经充满烧瓶的方法是_________________________________.
若经检验,二氧化碳气体已经充满烧瓶,迅速用橡皮塞塞好烧瓶瓶口,并称其质量为m2g.
(4)将烧瓶口橡皮塞取下,向烧瓶内注水至标记线,再将水小心地倒人量简,测量出水的体积为 V1mL;将该体积换算成标准状况时的体积为 V2mL. 请写出二氧化碳式量的计算式_______________________________________. 若不将气体净化和干燥,所测定的二氧化碳式量的数值将会________________(填“偏高”或“偏低”,其理由是_________________________________________________.
26.(10分)下面a-e是中学化学实验中常见的几种定量仪器: (a)量筒 (b)容量瓶 (c)滴定管 (d)托盘天平 (e)温度计 (1)其中标示出仪器使用温度的是___________________(填写编号); (2)能够用以精确量取液体体积的是_____________(填写编号); (3)由于错误操作,使得到的数据比正确数据偏小的是_________________(填写编号); (A)用量筒量取一定量液体时,俯视液面读数 (B)中和滴定达终点时俯视滴定管内液面读数 (C)使用容量瓶配制溶液时,俯视液面定容后所得溶液的浓度
(4)称取 10.5 g固体样品(1 g以下使用游码)时,将样品放在了天平的右盘,则所称样品 的实际质量为_____g.
(5)有下列实验:①苯与溴的取代反应 ②苯的硝化反应 ③乙醛的银镜反应 ④酚醛树 脂的制取 ⑤乙酸乙酯的制取 ⑥石油分馏实验 其中需要使用温度计的有___________________(填写编号).
25.用石墨电极电解pH=3的稀硫酸溶液50mL,通电1h停止电解.此时测得溶液的pH=2,已知每个电子所带电量为1.6×10-19C,则下列说法正确的是 (A)电源的电压为36V (B)阴、阳两极共产生168L气体 (C)电路中的电流强度约为134A (D)溶液的质量减少15g
第Ⅱ卷(非选择题共67分)
24.某K2CO3样品中含有Na2CO3,KNO3和Ba(NO3)2三种杂质中的一种或两种,现将6.9g样品溶于足量水中,得到澄清溶液.若再加入过量的CaCl2溶液,得到4.5g沉淀,对样品所含杂质的正确判断是 (A)肯定有KNO3和Na2CO3,没有Ba(NO3)2 (B)肯定有KNO3,没有Ba(NO3)2,可能还有Na2CO3 (C)肯定没有Na2CO3和Ba(NO3)2,可能有KNO3 (D)无法判断
23.一定条件下,在一密闭容器中通入一定量SO2和O2的混合气,发生如下反应:
 反应达平衡后SO2、O2和SO3的物质的量
之比为3:4:6,保持其他条件不变,降低温度后达到新的平衡时,O2和SO3的物质的量分别
是1.1mol和2.0mol,此时容器内SO2的物质的量应是
(A)0.7mol (B)0.9mol (C)1.1mol (D)1.3mol
反应达平衡后SO2、O2和SO3的物质的量
之比为3:4:6,保持其他条件不变,降低温度后达到新的平衡时,O2和SO3的物质的量分别
是1.1mol和2.0mol,此时容器内SO2的物质的量应是
(A)0.7mol (B)0.9mol (C)1.1mol (D)1.3mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com