
题目列表(包括答案和解析)
8. 在Na2SO4与K2SO4的混和溶液中,当[Na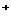 ]= 0.2摩/升, SO
]= 0.2摩/升, SO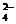 = x 摩/升,
= x 摩/升,
K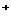 = y 摩/升,则x 和y 的关系是( )
= y 摩/升,则x 和y 的关系是( )
① x = 0.1+0.5y ② x = 0.5y
③ y = 2x-0.1 ④ y = 2(x-0.1)
(A) ①、③ (B) ①、④
(C) ②、④ (D) ③、④
7. 同温、同压下同体积的A 、B 两种气体或蒸气的质量比为23:16,当B的分子量为32 时,
则A 的分子式不可能是( )
① C2H6O ② CH2O2 ③ 气态烷烃 ④ N2O
(A) ①、② (B) ①、③
(C) ②、③ (D) ③、④
6. 将下列各组括号内的少量杂质除去的操作正确的是( )
(A) 福尔马林(甲酸):加Na2CO3 蒸馏
(B) 乙醇(水):加浓H2SO4 蒸馏
(C) O2(H2 、H2O):通过浓硫酸洗气,再通过灼热的CuO 粉末
(D) FeCl2溶液(FeCl3):加足量的铁粉,振荡、过滤
5. 某物质只含一种元素,则此物质( )
(A) 一定是一种单质
(B) 一定是纯净物
(C) 一定是混和物
(D) 可能是纯净物,也可能是混和物
4. 下列对熔、沸点变化规律叙述正确的是( )
(A) 同主族元素的单质,熔点都随原子序数的增加而升高。
(B) 卤化氢的沸点随 原子序数的增大而升高。
(C) 烷烃沸点随分子中的碳原子数增多而升高;当分子中碳原子相等时,支链越少,
其沸点越高。
(D) 低级饱和脂肪卤代烃的沸点随分子中碳原子数增多而降低。
3. 下列八种工业生产,可直接用到石灰石的是( )
① 炼铁 ② 炼钢 ③ 制硅酸盐水泥 ④ 制普通玻璃
⑤ 制漂白粉 ⑥ 制电石 ⑦ 制波尔多液 ⑧ 制过磷酸钙肥料
(A) ①②③④ (B) ①③④⑥
(C) ①③④⑤ (D) ②③④⑧
2. 下列微粒的空间结构呈正四面体,但键角不是109 度28分的是( )
(A) 白磷P4 (B) 四氯化碳CCl4
(C) 铵根离子 NH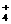 (D) 磷化氢PH3
(D) 磷化氢PH3
每小题只有一个选项符合题意。
可能用到的原子量:
H 1 He 4 C12 N 14 O 16 Na 23
Mg24 Al 27 S32 Cl35.5 Zn 65
1. 工业上制取镁粉的方法是将镁的蒸气进行冷却,其中下列最适宜的方法是( )
(A) 在氮气的容器内冷却
(B) 在水中冷却
(C) 在氢气中冷却
(D) 在二氧化碳气体里冷却
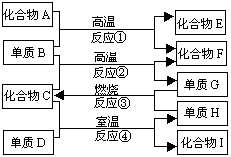
如上图,已知:
①化合物E与水反应生成白色浆状物;②化合物F是不能生成盐的氧化物③单质D能与某些稀有气体反应;据此,请填空;
(1)化合物F是________.
(2)化合物I是_________.
(3)反应②的化学方程式是_______________________________.
(4)反应④的化学方程式是_______________________________.
六、(本题包括2小题,共20分)
30.(6分)有如下反应 军事上的“地表伪装”是军事上
保护的外观色彩、红外反射与环境吻合.BASF是菲系新型红外伪装还原染料,为橄榄色或黑色.其化学结构为:
军事上的“地表伪装”是军事上
保护的外观色彩、红外反射与环境吻合.BASF是菲系新型红外伪装还原染料,为橄榄色或黑色.其化学结构为:
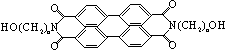
(1)料BASF的分子式_____________;
(2)1mol该物质与Na反应,产生氢气量以及在催化剂作用下加成所需氢气物质的量,最大值分别为_________,__________;
(3)当n=3时,其一氯取代物可能有__________种;
(4)和N原子直接相连的C原子________(填能或不能)处于同一平面.
31.(14分)
已知: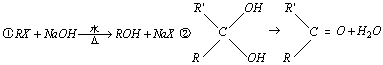 烃A能
发生下面一系列化学反应:
烃A能
发生下面一系列化学反应:

(1) 请写出下列物质的结构简式: A___________,C___________,E___________,G___________. (2)写出化学方程式: ②________________________________,⑤________________________________. (3)属于加成反应的有________________,E--G的反应类型是___________. 七、(本题包括2小题共15分) 32.(7分)环保检测中,有害气体的浓度常用1L有害气体的毫克值(mg·L-1)来表示,如对某气体样品中所含一氧化碳的浓度进行测定,其方法和实验步骤如下: ①首先将2.00L的气体样品通过盛有I2O5固体的加热管,反应后生成CO2和I2; ②用30.0mL 5.00×10-3mol·L-1的硫代硫酸钠溶液吸收所产生的碘,发生的反应为: ③将②中溶液取出1/5,加入1.00mL 1.00×10-2mol·L-1碘水,正好将所取溶液中过量的硫代硫酸钠完全氧化. (1)写出步骤①中CO通过盛I2O5加热管的有关反应化学方程式. (2)计算样品中CO的浓度. 33.(8分)向100mL某二价金属M的氢氧化物澄清溶液中加入过量的NaHCO3溶液,生成了MCO3沉淀,过滤,将沉淀置于足量的盐酸溶液中,在标准状况下收集到4.48L气体.将滤液加水稀释至250mL,取出25mL恰好与20mL盐酸完全反应,在标准状况下收集到1.12L气体. (1) M的氢氧化物澄清溶液与NaHCO3溶液反应的化学方程式为: ______________________________________________________.
(2)要计算金属M的原子量,你认为还必须提供下列哪项数据(填写供选项字母序号) _________________. (A)M的氢氧化物溶液的物质的量的浓度(设为2mol·L-1) (B)M的碳酸盐的质量(设为39.4g) (C)与M的碳酸盐反应的盐酸的物质的量浓度(设为0.1mol·L-1) (D)题设条件充足,不需要补充数据. (3)根据你的选择,试计算金属M的原子量和加入的NaHCO3溶液中所含的NaHCO3的质量
33.(8分)为了度量水中有机物等还原性污染物的含量,通常把1 L水样与强氧化剂完全作用时消耗氧化剂的量,折算成以氧气为氧化剂时的质量(O2 mg·L-1)来表示,称为该水样的化学耗氧量(COD).我国明文规定:COD> 500 mg·L-1的污水不得直接排放. 为测定某工业废水的COD,实验如下:量取废水样品20.00 mL,加人0.100 mol·L-1 KMnO4溶液10.00 mL和少量稀H2SO4,在一定条件下充分反应后,再用 0.200 mol·L-1的草酸钠(Na2C2O4)溶液滴定过量的 KMnO4,达到终点时消耗Na2C2O4溶液11.00 mL. (1)写出在酸性介质中KMnO4(被还原为Mn2+)与Na2C2O4(被氧化CO2)反应的离子方程 ___________________________________________. (2)计算该水样的COD,写出计算过程. (3)如果每次取水样20.00mL,加入等体积的0.100mol·L-1酸性KMnO4溶液,为简化计算,令滴定过量KMnO4时,每消耗1.00mL Na2C2O4溶液,就相当于水样的COD为10.0mg·L-1, 该Na2C2O4溶液的物质的量浓度应配制为_________________.
(4)若无需其他计算,只需通过实验测定下列两组方案中a与b 的值,并直接根据a与b的比值来确定该工业废水可否直接排放.你认为其中适宜可行的方案是_______(填写编号) ;并根据你的选择计算:当a/b(填写取值范围)______________时,该工业废水不能直接排放.
|
实验方案 |
V(水样)
mL |
V(KMnO4溶液)
mL |
c(KmnO4)
mol·L-1 |
V(Na2C2O4溶液)
mL |
C(Na2C2O4)
mol·L-1 |
|
A |
a |
a |
0.100 |
b |
0.100 |
|
B |
a |
20.00 |
0.100 |
20.00 |
b |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com