
题目列表(包括答案和解析)
1].下列化学名词正确的是
A 三溴笨酚 B 烧碱 C 乙酸乙脂 D 石碳酸
31].(18分)
(1)限制性内切酶Ⅰ的识别序列和切点是-G↓GATCC-,限制性内切酶Ⅱ的识别序列和切点是-↓GATC-。在质粒上有酶Ⅰ的一个切点,在目的基因的两侧各有1个酶Ⅱ的切点。
①请画出质粒被限制酶Ⅰ切割后所形成的黏性末端。
②请画出目的基因两侧被限制酶Ⅱ切割后所形成的黏性末端。
③在DNA连接酶的作用下,上述两种不同限制酶切割后形成的黏性末端能否连接起来?为什么?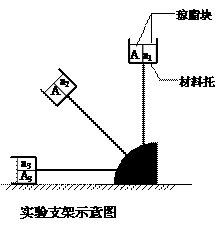
(2)请根据所提供的实验材料用具设计一个实验,验证“重力影响生长素的重新分配”。
实验材料用具:若干相同的燕麦胚芽鞘尖端是、若干相同的去掉尖端的胚芽鞘、一个实验支架(支架的材料托中,放置了6块已编号的相同琼脂块。相邻两个琼脂块之间用不透水的云母片完全割开)。
①写出主要实验步骤:
②预期实验结果:
放置a1琼脂块的胚芽鞘比放置a2琼脂块的胚芽鞘_______________。
放置a3琼脂块的胚芽鞘比放置a2琼脂块的胚芽鞘_____________。
放置A3琼脂块的胚芽鞘________________________。
30].(18分)
(1)19世纪中叶以来,随着英国重工业的发展,尺蛾中黑化蛾的比例越来越高。为了研究环境改变对尺蛾种群变化的影响,1950年科学工作者在英国的两个地区利用标志重捕法进行了调查,获得如下结果:
|
项目 地区 |
白色蛾 |
黑化蛾 |
||||
|
释放数 |
回收数 |
回收率 |
释放数 |
回收数 |
回收率 |
|
|
污染区 |
64 |
16 |
25.0% |
154 |
82 |
53.2% |
|
非污染区 |
393 |
54 |
13.7% |
406 |
19 |
4.7% |
请回答下列问题:
①自然选择是________________________________的过程。
 ②表中两组数据________________大于________________、________________大于________________共同支持“自然选择决定生物进化方向”这一论点。
②表中两组数据________________大于________________、________________大于________________共同支持“自然选择决定生物进化方向”这一论点。
(2)20世纪50年代后,英国开始实行控制计划,大气环境污染得到了治理。请根据下图说出三者的变化关系并解释原因。
29].(14分)磷在氧气中燃烧,可能生成两种固态氧化物。3.1 g的单质磷(P)在3.2 g氧气中燃烧,至反应物耗尽,并放出X kJ热量。
(1)通过计算确定反应产物的组成(用化学式表示)是 ,其相应的质量(g)为 。
(2)已知单质磷的燃烧热为Y kJ/mol,则1mol P与O2反应生成固态P2O3的反应热 ΔH= 。
(3)写出1mol P与O2反应生成固态P2O3的热化学方程式: 。
(4)写出D和E的结构简式: 。
(5)写出B的结构简式: 。
(6)写出天然油脂A的一种可能结构简式: 。
28].(19分)根据侯德榜制碱法原理并参考下表的数据,实验室制备纯碱Na2CO3的主要步骤是:将配制好的饱和NaCl溶液倒入烧杯中加热,控制温度在30-35℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕后,继续保温30分钟,静置、过滤得NaHCO3晶体。用少量蒸馏水洗涤除去杂质,抽干后,转入蒸发皿中,灼烧2小时,制得Na2CO3固体。
四种盐在不同温度下的溶解度(g/100g水)表
 |
0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
50℃ |
60℃ |
100℃ |
|
NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
39.8 |
|
NH4HCO3 |
11.9 |
15.8 |
21.0 |
27.0 |
-① |
- |
- |
- |
|
NaHCO3 |
6.9 |
8.1 |
9.6 |
11.1 |
12.7 |
14.5 |
16.4 |
- |
|
NH4Cl |
29.4 |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
55.3 |
77.3 |
①>35℃NH4HCO3会有分解
请回答:
(1)反应温度控制在30-35℃,是因为若高于35℃,则 ,若低于30℃,则 ;为控制此温度范围,采取的加热方法为 。
(2)加料完毕后,继续保温30分钟,目的是 。静置后只析出NaHCO3晶体的原因是 。用蒸馏水洗涤NaHCO3晶体的目的是除去 杂质(以化学式表示)。
(3)过滤所得的母液中含有 (以化学式表示),需加入 ,并作进一步处理,使NaCl溶液循环使用,同时可回收NH4Cl。
(4)测试纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1-2滴酚酞指示剂,用物质的量浓度为c(mol/L)的HCl溶液滴定至溶液由红色到无色(指示CO32-+H+=HCO3-反应的终点),所用HCl溶液体积为V1 mL,再加1-2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,所用HCl溶液总体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:NaHCO3(%)=
26、(9分) 今有碱金属的两种碳酸盐和碱土金属(第二主族)的一种不溶性碳酸盐组成的混合物,取其7.560g与过量的盐酸完全反应,放出CO2体积为1.344L(标准状况),另取
等质量的原混合物,加水搅拌,可滤出不溶性盐1.420g。
 (1)取过滤后的滤液的1/10体积,向其中缓慢滴加浓度为0.2500mol·L-1盐酸,并同时记录放出CO2体积(标准状况)和消耗盐酸的体积,得到如图所示的曲线。试计算确定这两种碱金属碳酸盐的化学式。
(1)取过滤后的滤液的1/10体积,向其中缓慢滴加浓度为0.2500mol·L-1盐酸,并同时记录放出CO2体积(标准状况)和消耗盐酸的体积,得到如图所示的曲线。试计算确定这两种碱金属碳酸盐的化学式。
(2)将滤出的不溶性盐(1.420g)投入到浓度为2.5mol/L盐酸中,完全反应时,耗去盐酸16.00mL,试计算确定原不溶性碳酸盐化学式。
25.(4分)设X、Y、z代表三种元素。已知:
①x’和Y一两种离子具有相同的电子层结构;②Z元素原子核内质子数比Y元素原子
核内质子数少9个;③Y和Z两种元素可以形成4核42个电子的负一价阴离子。据此,请填空:
(1)Y元素是 ;Z元素是 。
(2)由X、Y、Z三种元素所形成的含68个电子的盐类化合物的化学式是 。
24.(6分) 归纳整理是科学学习的重要方法之一。在学习了氧族元素的各种性质后,可归纳整理出下表所示的表格(部分)。
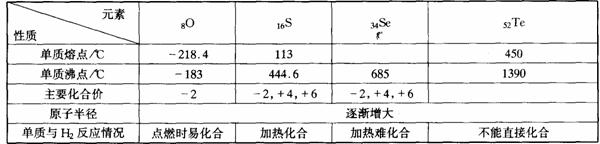
请回答下列问题:
(1)硒的熔点范围可能是 。 (2)碲的化合价可能有 。
(3)硫、硒、碲的氢化物水溶液的酸性由强至弱的顺序是 (填化学式)。
(4)氢硒酸有较强的 (填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生的化学方程式为 。
(5)工业上Al2Te3可用来制备H2Te,完成下列化学方程式:
Al2Te3+( )→Al(OH)3↓+ H2Te↑
(6)如图所示为氧族元素单质与H2反应过程中的能量变化示意图,其中a、b、c、d分别表示氧族中某一元素的单质,ΔE为相同物质的量的单质与H2反应过程中的能量变化(反应的热效应)。
 则:b代表 ,d代表 (均写单质名称)。
则:b代表 ,d代表 (均写单质名称)。
23、 (6分) 如图所示,甲、乙、丙是三种常见单质,X、Y、Z是三种常见的化合物,它们之间有如下转化关系:
(6分) 如图所示,甲、乙、丙是三种常见单质,X、Y、Z是三种常见的化合物,它们之间有如下转化关系:
(1)若甲是具有还原性的单质,X、Y、Z中有一种是离子晶体,则:
①X、Y、Z中含有丙元素的是 (填代号);
②乙的化学式是 ;
③X与甲反应的化学方程式是 。
(2)若甲是具有氧化性的单质,丙在通常状况下呈液态,Y和Z具有相同的阳离子,则X与足量的甲在溶液中完全反应的离子方程式是 。
22.(7分)有A、B、C、D、E、F、G七种元素,试按下述所给的条件推断。
①A、B、C是同一周期的金属元素,已知原子核外有3个电子层,A的原子半径在所属周期中最大且原子半径A>B>C。
②D、E是非金属元素,它们跟氢化合可生成气态氢化物HD和HE,在室温时,D的单质是液体,E的单质是固体。
③F在常温下是气体,性质稳定,是除氢外最轻的气体。
④G是除氢外原子半径最小的元素。
(1)A的名称是 ;B位于周期表中第 周期,第 族;C的原子结构示
意图是 。
(2)E的单质颜色是 。
(3)A元素与D元素形成化合物的电子式是 。
(4)G的单质与水反应的化学方程式是 。
(5)F的元素符号是 。
(6)在上述七种元素中,最高价氧化物对应的水化物碱性最强的化学式是 ;酸性最强的化学式是 ;气态氢化物最稳定的化学式是 。
(7)将C的氧化物对应的水化物投入到A的氧化物对应的水化物中反应的化学方程式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com