
题目列表(包括答案和解析)
有A、B两种溶液,A是把蒙有10.2克氧化铝的铝条放入1升1.5摩/升热NaOH溶液里,过会儿取出铝条,溶液增重12.6克。B是把蒙有氧化铝的铝条放入1升0.9摩/升的硫酸溶液,过会儿取出铝条,溶液增重25.2克。假设A、B两溶液最后的体积仍为1升。
回答下列问题:
A溶液中的溶质是什么?其物质的量的浓度是多少?
6. 某液态有机物A6.2 克与足量镁粉反应,生成2.24 升H2(标准状态下),A与Na2CO3溶液不反应;在同温同压下测得A气体的密度为CO2气体密度的1.41倍。A分子内脱水可得B,A分子间脱水可得C或D。A氧化得E,E再氧化得F。A与F脱水可得G或H。
(1) 推断、写出结构简式:A______________C______________D_______________。
答:
(2) 写出A与F分子间脱水的化学方程式.
答:
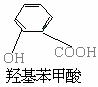 7.
化合物A,学名为邻羟基苯甲酸,俗名水杨酸,其结构简式如下图所示:
7.
化合物A,学名为邻羟基苯甲酸,俗名水杨酸,其结构简式如下图所示:
(1) 将A跟哪种物质的溶液反应可得到一种钠盐,
其化学式为C7H5O3Na?( )
(A) NaOH (B) Na2S
(C) NaHCO3 (D) NaCL
(2)水杨酸的同分异构体中属于酚类,但是不属于酯类、也不属于羧酸类的化合物必定含
有_____基。 ( )
(A) 羟基 (B) 羧基
(C) 醛基 (D) 酚基
5. 在298K时,向V 升真空容器内通入N 摩SO2和M 摩H2S。
(1) 若N = 2 时,则当M 〉( )时,反应后容器内气体的密度最小。
(2) 若2N 〉M ,则反应后氧化产物与还原产物的质量差为( )克。
(3) 若5N = M ,且反应后氧化产物与还原产物的质量之和为48克,则N+M=( ).
3. 将自然界的矿物胆矾(CuSO4·5H2O)溶于水中,若遇到黄铁矿(FeS2),就会发生反应,生成辉铜矿(Cu2S)、硫酸亚铁和硫酸。在有些矿区见到的具有强酸性、强腐蚀性的地下水,俗称“黑水”,就是经过这种反应产生的。
14CuSO4 + 5Fe2S + 12H2O = 7Cu2S + 5FeSO4 + 12H2SO4.反应中,
被氧化的硫原子与被还原的硫原子的物质的量之比为( )。
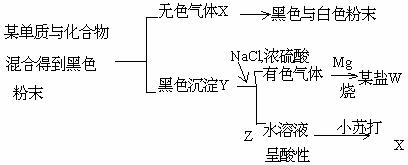 4.
根据下列图示,回答问题。
4.
根据下列图示,回答问题。
(1).原两种黑色粉末的名称是(碳)和(二氧化锰);
判断对错:( )
W 盐的化学式为( ALCL3 )。
判断对错:( )
(2). X 与Mg 的反应的化学方程式为: CO2 + 2Mg = 2MgO + C.
判断对错:( )
(3). Z 溶液呈酸性的主要原因是NaHSO4 = Na + H
+ H + SO
+ SO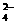 .
.
判断对错: ( )
|
1. 如图所示,在支管锥形瓶A中充满等体积的H2S和NO气体;在分液漏斗B中盛有淀粉碘 化钾溶液;在锥形瓶的支管处用弹簧夹b夹紧,并充满O2的气球C。根据实验,填写:
|
(1).打开分液漏斗的活塞a,将漏斗中的溶液缓慢的流入A中,
发生的变化是:( H2S 气体溶于KI溶液中 )。
请判断:( )
(2).松开弹簧夹b,气球C逐渐_________,
锥形瓶A中的气体 颜色立即变成__________. ( )
(A)增大 棕色 (B)缩小 红色
(C)缩小 棕色 (D)增大 红色
(3).锥形瓶A中的溶液开始变混浊,这是因为______.
(用化学方程式表示)。 ( )
(A)2NO + O2 = 2NO2 (B) H2S + 2NO2 = 2HNO3 + S
(C)2KI + 2NO2 = 2KNO3 + I2 (D)以上都不对。
(4).锥形瓶A中的溶液开始变混浊,在溶液中变混浊的同时,
溶液出现浅蓝色,这是因为( )
(A)2NO + O2 = 2NO2 (B)H2S + 2NO2 = 2HNO3 + S
(C)2KI + 2NO2 = 2KNO3 + I2 (D)以上都不对。
2. 在实验室中制取少量乙酸乙酯的主要步骤如下:
① 把2毫升乙醇、1毫升浓硫酸装入反应的试管中,再加入2毫升10% 的醋酸。
② 在收集试管中,装入饱和的NaOH 溶液,组装好全部装置。
③ 将反应试管加强热,保持剧烈沸腾。
④ 倒出收集试管中的上层液体,即得到产品乙酸乙酯。
指出以上①-④步骤中的主要错误,并回答有关问题:
错误处:
① ________________________________________________________________________,
②________________________________________________________________________,
③________________________________________________________________________,
④________________________________________________________________________,
问题:
(1).步骤③操作的作用是(应小心加热,使酯化反应充分进行,并把乙酸乙酯蒸出)。
判断对错:( )
(2).收集试管中的导管为什么不能插入溶液中?
[答]:
(3).乙酸乙酯的主要用途是_________________,___________________。
25. 将金属镁、铝、铁的单质分别投入到质量相等、浓度相同的稀硫酸中,待反应结束后,
各溶液的质量仍相等,则投入的镁、铝、铁的质量比为( )
(A)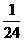 :
: 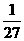 :
: 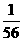 (B)
(B) 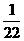 :
: 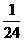 :
: 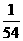
(C) 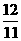 :
: 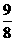 :
: 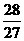 (D)
(D) 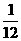 :
: 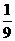 :
: 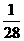
24.某硝酸与过量的铁粉反应,共生成4.48升N2O 气体(在标准状况下),如改与铝粉反应(生
成NO气体),则最后可溶解铝为( )
(A) 13.5克 (B) 6.75克
(C) 2.7克 (D) 9.0克
23. 当25 ℃时,在下列相同摩尔浓度的溶液中,水的电离度由大到小排列正确的是( )
① KNO3 ② NaOH ③ NaCl ④ (NH4)2SO4
(A) ②>④>①=③ (B) ④>①=③>②
(C) ①=③>④>② (D) ④>②>①=③
22. 有一硫化钠、亚硫酸钠和硫酸钠的混和物,经测定,含硫25.6%,则此混和物含氧量为 ( )
(A) 37.6% (B) 36.8%
(C) 51.2% (D) 无法计算
21. 在甲、乙、丙、丁四个烧杯内各放入0.1摩的钠、氧化钠、过氧化钠和氢氧化钠,然后各加入100毫升水。下列对固体完全溶解后所得各溶液的质量百分比浓度关系表达正确的是( )
(A) 甲<乙<丙<丁 (B) 丁<甲<乙=丙
(C) 甲=丁<乙=丙 (D) 丁<甲<乙<丙
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com