
题目列表(包括答案和解析)
21.(8分)已知25℃时0.1 mol·L-1醋酸溶液的pH约为3,向其中加入少量醋酸钠晶体,待晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了c(OH-),因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因而pH增大。你认为上述解释中 (“甲”或“乙”)正确。
(1)为了验证上述哪种解释正确,继续做如下实验:向0.1 mol·L-1的醋酸溶液中加入少量的下列物质中的 (填写编号),然后测定溶液的pH。
A.固体CH3COOK B.固体CH3COONH4
C.气体NH3 D.固体NaHCO3
(2)若 (填“甲”或“乙”)的解释正确,溶液的pH应 (填“增大”“减少”或“不变”)。
20.(14分)按如图装置和以下实验步骤,可以制取少量的溴苯和溴乙烷。①按图连接仪器装置,并检查装置的气密性;②气密性良好,再向烧瓶中加入少量苯和液溴,向锥形瓶中加入乙醇和浓硫酸混合液至恰好浸没导管C出口;③将A装置中的纯铁丝小心地向下插入液体中;④点燃B装置中的酒精灯,用小火缓缓地对锥形瓶加热10 min。据此填写和回答下列要求:
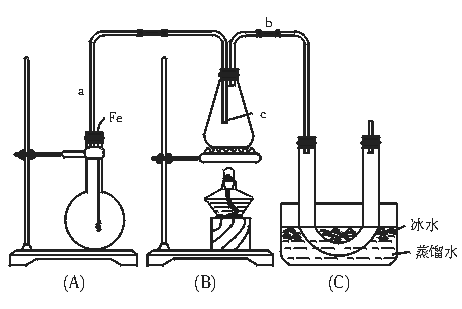
(1)写出本题制取溴苯和溴乙烷的两个化学方程式 、
。
(2)将铁丝小心地向下插入A烧瓶内液体中,观察到的现象是 。
(3)长导气管a的作用是 ,导管b的作用是 。
(4)U形管内用蒸馏水封住管底,其作用是 。
(5)反应完毕后,U型管内的现象是 ;分离出溴乙烷所用到的主要仪器的名称是 。
19.(9分)实验室制取乙酸乙酯,有如下实验步骤:①向干燥的大试管中加入3 mL无水乙醇,2 mL浓硫酸,2 mL冰醋酸;②把仪器安装好,用酒精灯小心加热试管3~5分钟;③馏出成分用饱和碳酸钠溶液吸收;④将馏出物质和饱和碳酸钠溶液倒入分液漏斗中,进行分液即得到乙酸乙酯。请填写以下空白:
(1)步骤①加入浓硫酸的注意事项是 。
(2)在接收馏出成分的装置中,饱和碳酸钠溶液所起的作用是 。
(3)用分液漏斗分液时,将混合液体倒入分液漏斗后, 后,分出下层液体 (填“酯液”或“水液”)至 ,关闭分液漏斗的活塞。剩下的上层液体
出。(填“从上口倒出”或“从下口倒出”)
18.向紫色Cr2(SO4)3溶液中,加入NaOH溶液至pH为4.6时,溶液中析出蓝灰色沉淀,
 此时,溶液中存在着如下平衡关系:
此时,溶液中存在着如下平衡关系:
将上述溶液分成两等份,分装在a、b两试管中,向a试管中加入适量的NaOH溶液;向b试管中加入适量的H2SO4溶液。其颜色依次为
|
|
A |
B |
C |
D |
|
a试管中 |
紫色 |
蓝灰色 |
蓝色 |
绿色 |
|
b试管中 |
绿色 |
绿色 |
紫色 |
紫色 |
第Ⅱ卷(非选择题 共76分)
17.用物质的量都是0.1 mol的HCN和NaCN配成1 L溶液,已知溶液中c(CN-)<c(Na+)>c(H+)>c(OH-),下列关系正确的是
A.c(Na+)>c(CN-)>c(H+)>c(OH-) B.c(CN-)+c(HCN)=0.2 mol·L-1
C.c(CN-)+c(OH-)=0.1 mol·L-1 D.c(Na+)+c(H+)=c(CN-)
16.下列溶液中的各组离子,因发生氧化还原反应而不能大量共存的是
A.H+、Na+、NO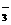 、SO
、SO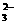 B.AlO
B.AlO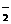 、OH-、Na+、NH
、OH-、Na+、NH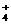
C.Fe3+、SCN-、SO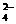 、Cl- D.Fe3+、HS-、Cl-、NH
、Cl- D.Fe3+、HS-、Cl-、NH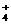
15.下列各组混合物不能用分液漏斗分离的是
A.硝基苯和水 B.苯和甲苯
C.溴苯和NaOH溶液 D.氯仿酒精
14.取pH=2的盐酸和醋酸各100 mL。分别稀释10倍后,再分别加入0.03 g Zn粉,在相同条件下充分反应,有关叙述正确的是
A.醋酸与锌反应放出H2多
B.盐酸与锌反应放出H2多
C.盐酸和醋酸分别与锌反应的速率一样
D.盐酸和醋酸分别与锌反应放出H2一样多
13.顺利运输鱼苗,必须满足四个条件:①需要保持充足的氧气;②使鱼苗呼出的CO2气体及时排出;③防止细菌大量繁殖;④水溶液pH要调节在8~8.5。已知下列四种物质加入水中都可起到供氧作用(过氧化钙极微溶于水),在长距离储运鱼苗的水中,最好加入的是
A.过氧化钠 B.氯水 C.过氧化钙 D.双氧水
12.室温下,pH=12的氢氧化钠溶液和pH=8的氢氧化钠溶液等体积混合后,混合溶液中由水电离出的c(H+)为
A.5×10-8 mol·L-1 B.2×10-12 mol·L-1
C.5×10-3 mol·L-1 D.5×10-12 mol·L-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com