
题目列表(包括答案和解析)
1、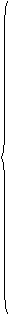 定义:相邻的两个或多个原子之间强烈的相互作用。
定义:相邻的两个或多个原子之间强烈的相互作用。
|
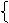 ①、定义:阴阳离子间通过静电作用所形成的化学键
①、定义:阴阳离子间通过静电作用所形成的化学键
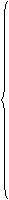 ②、存在:离子化合物(NaCl、NaOH、Na2O2等);离子晶体。
②、存在:离子化合物(NaCl、NaOH、Na2O2等);离子晶体。
 ①、定义:原子间通过共用电子对所形成的化学键。
①、定义:原子间通过共用电子对所形成的化学键。
|
 共价键
分子、原子、离子晶体。
共价键
分子、原子、离子晶体。

|

|
|

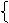 2、分类
极性键
共价化合物
2、分类
极性键
共价化合物


 化学键
非极性键 非金属单质
化学键
非极性键 非金属单质
|
 ③、分类:
③、分类:
|
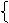 双方提供:共价键
双方提供:共价键

|
金属键:金属阳离子与自由电子之间的相互作用。存在于金属单质、金属晶体中。



|
|
|
|
|

 键能
键能
5、同一元素不同价态的微粒半径,价态越高离子半径越小。如Fe>Fe2+>Fe3+
 ①与水反应置换氢的难易
①与水反应置换氢的难易
②最高价氧化物的水化物碱性强弱
 金属性强弱 ③单质的还原性或离子的氧化性(电解中在阴极上得电子的先后)
金属性强弱 ③单质的还原性或离子的氧化性(电解中在阴极上得电子的先后)
④互相置换反应
 依据:
⑤原电池反应中正负极
依据:
⑤原电池反应中正负极
 ①与H2化合的难易及氢化物的稳定性
①与H2化合的难易及氢化物的稳定性
元素的 非金属性强弱 ②最高价氧化物的水化物酸性强弱
金属性或非金属 ③单质的氧化性或离子的还原性
性强弱的判断 ④互相置换反应
 ①、同周期元素的金属性,随荷电荷数的增加而减小,如:Na>Mg>Al;非金属性,随荷电荷数的增加而增大,如:Si<P<S<Cl。
①、同周期元素的金属性,随荷电荷数的增加而减小,如:Na>Mg>Al;非金属性,随荷电荷数的增加而增大,如:Si<P<S<Cl。
规律: ②、同主族元素的金属性,随荷电荷数的增加而增大,如:Li<Na<K<Rb<Cs;非金属性,随荷电荷数的增加而减小,如:F>Cl>Br>I。
③、金属活动性顺序表:K>Ca>Mg>Al>Zn>Fe>Sn>Pb>(H)>Cu>Hg>Ag>Pt>Au
 定义:以12C原子质量的1/12(约1.66×10-27kg)作为标准,其它原子的质量跟它比较所得的值。其国际单位制(SI)单位为一,符号为1(单位1一般不写)
定义:以12C原子质量的1/12(约1.66×10-27kg)作为标准,其它原子的质量跟它比较所得的值。其国际单位制(SI)单位为一,符号为1(单位1一般不写)
 原子质量:指原子的真实质量,也称绝对质量,是通过精密的实验测得的。
原子质量:指原子的真实质量,也称绝对质量,是通过精密的实验测得的。
如:一个Cl2分子的m(Cl2)=2.657×10-26kg。
核素的相对原子质量:各核素的质量与12C的质量的1/12的比值。一种元素有几种同位素,就应有几种不同的核素的相对原子质量,
相对原子质量 诸量比较: 如35Cl为34.969,37Cl为36.966。
(原子量) 核素的近似相对原子质量:是对核素的相对原子质量取近似整数值,数值上与该核素的质量数相等。如:35Cl为35,37Cl为37。
元素的相对原子质量:是按该元素各种天然同位素原子所占的原子百分比算出的平均值。如:Ar(Cl)=Ar(35Cl)×a% + Ar(37Cl)×b%
元素的近似相对原子质量:用元素同位素的质量数代替同位素相对原子质量与其丰度的乘积之和。
注意: ①、核素相对原子质量不是元素的相对原子质量。
①、核素相对原子质量不是元素的相对原子质量。
②、通常可以用元素近似相对原子质量代替元素相对原子质量进行必要的计算。
 定义:核电荷数相同,中子数不同的核素,互称为同位素。(即:同种元素的不同原子或核素)
定义:核电荷数相同,中子数不同的核素,互称为同位素。(即:同种元素的不同原子或核素)
 同位素 ①、结构上,质子数相同而中子数不同;
同位素 ①、结构上,质子数相同而中子数不同;
特点: ②、性质上,化学性质几乎完全相同,只是某些物理性质略有不同;
③、存在上,在天然存在的某种元素里,不论是游离态还是化合态,同位素的原子(个数不是质量)百分含量一般是不变的(即丰度一定)。
4、电子层结构相同的离子半径随核电荷数的增大而减小。如:F-> Na+>Mg2+>Al3+
2、同主族元素的原子半径随核电荷数的增大而增大。如:Li<Na<K<Rb<Cs
具体规律: 3、同主族元素的离子半径随核电荷数的增大而增大。如:F--<Cl--<Br--<I--
2003.11
|
化学反应及能量变化
 实质:有电子转移(得失与偏移)
实质:有电子转移(得失与偏移)
特征:反应前后元素的化合价有变化
还原性 化合价升高 弱氧化性

|


 ↑
↑

|

|

 还原剂
氧化反应 氧化产物
还原剂
氧化反应 氧化产物
|

 氧化剂
还原反应
还原产物
氧化剂
还原反应
还原产物


 ↓
↓


 ↓
↓
氧化性 化合价降低 弱还原性
 氧化还原反应:有元素化合价升降的化学反应是氧化还原反应。
氧化还原反应:有元素化合价升降的化学反应是氧化还原反应。
有电子转移(得失或偏移)的反应都是氧化还原反应。
概念: 氧化剂:反应中得到电子(或电子对偏向)的物质(反应中所含元素化合价降低物)
还原剂:反应中失去电子(或电子对偏离)的物质(反应中所含元素化合价升高物)
氧化产物:还原剂被氧化所得生成物;
还原产物:氧化剂被还原所得生成物。
 失电子,化合价升高,被氧化
失电子,化合价升高,被氧化
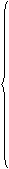
 双线桥:
双线桥:
氧化剂 + 还原剂 = 还原产物 + 氧化产物

得电子,化合价降低,被还原
电子转移表示方法 单线桥: 电子

还原剂 + 氧化剂 = 还原产物 + 氧化产物
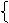 二者的主 表示意义、箭号起止
二者的主 表示意义、箭号起止
要区别: 电子数目等
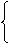 依据原则:氧化剂化合价降低总数=还原剂化合价升高总数
依据原则:氧化剂化合价降低总数=还原剂化合价升高总数

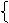 找出价态变化,看两剂分子式,确定升降总数;
找出价态变化,看两剂分子式,确定升降总数;
方法步骤:求最小公倍数,得出两剂系数,观察配平其它。
有关计算:关键是依据氧化剂得电子数与还原剂失电子数相等,列出守恒关系式求解。

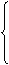 ①、由元素的金属性或非金属性比较;(金属活动性顺序表,元素周期律)
①、由元素的金属性或非金属性比较;(金属活动性顺序表,元素周期律)
 ②、由反应条件的难易比较;
②、由反应条件的难易比较;
③、由氧化还原反应方向比较;(氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物)
④、根据(氧化剂、还原剂)元素的价态与氧化还原性关系比较。
 元素处于最高价只有氧化性,最低价只有还原性,处于中间价态既有氧化又有还原性。
元素处于最高价只有氧化性,最低价只有还原性,处于中间价态既有氧化又有还原性。
 ①、活泼的非金属,如Cl2、Br2、O2 等;
①、活泼的非金属,如Cl2、Br2、O2 等;
②、元素(如Mn等)处于高化合价的氧化物,如MnO2、KMnO4等
氧化剂: ③、元素(如S、N等)处于高化合价时的含氧酸,如浓H2SO4、HNO3 等
④、元素(如Mn、Cl、Fe等)处于高化合价时的盐,如KMnO4、KClO3、FeCl3、K2Cr2O7
⑤、过氧化物,如Na2O2、H2O2等。
 ①、活泼的金属,如Na、Al、Zn、Fe 等;
①、活泼的金属,如Na、Al、Zn、Fe 等;
②、元素(如C、S等)处于低化合价的氧化物,如CO、SO2等
还原剂: ③、元素(如Cl、S等)处于低化合价时的酸,如浓HCl、H2S等
④、元素(如S、Fe等)处于低化合价时的盐,如Na2SO3、FeSO4等
⑤、某些非金属单质,如H2 、C、Si等。
 概念:在溶液中(或熔化状态下)有离子参加或生成的反应。
概念:在溶液中(或熔化状态下)有离子参加或生成的反应。
 离子互换反应
离子互换反应
 离子非氧化还原反应 碱性氧化物与酸的反应
离子非氧化还原反应 碱性氧化物与酸的反应
类型: 酸性氧化物与碱的反应
 离子型氧化还原反应 置换反应
离子型氧化还原反应 置换反应
一般离子氧化还原反应
 化学方程式:用参加反应的有关物质的化学式表示化学反应的式子。
化学方程式:用参加反应的有关物质的化学式表示化学反应的式子。
 用实际参加反应的离子符号表示化学反应的式子。
用实际参加反应的离子符号表示化学反应的式子。
表示方法 写:写出反应的化学方程式;
写:写出反应的化学方程式;
离子反应: 拆:把易溶于水、易电离的物质拆写成离子形式;
离子方程式: 书写方法:删:将不参加反应的离子从方程式两端删去;
查:检查方程式两端各元素原子种类、个数、电荷数是否相等。
意义:不仅表示一定物质间的某个反应;还能表示同一类型的反应。
本质:反应物的某些离子浓度的减小。
 金属、非金属、氧化物(Al2O3、SiO2)
金属、非金属、氧化物(Al2O3、SiO2)
 中学常见的难溶物 碱:Mg(OH)2、Al(OH)3、Cu(OH)2、Fe(OH)3
中学常见的难溶物 碱:Mg(OH)2、Al(OH)3、Cu(OH)2、Fe(OH)3
 生成难溶的物质:Cu2++OH-=Cu(OH)2↓ 盐:AgCl、AgBr、AgI、CaCO3、BaCO3
生成难溶的物质:Cu2++OH-=Cu(OH)2↓ 盐:AgCl、AgBr、AgI、CaCO3、BaCO3
生成微溶物的离子反应:2Ag++SO42-=Ag2SO4↓
发生条件 由微溶物生成难溶物:Ca(OH)2+CO32-=CaCO3↓+2OH-
生成难电离的物质:常见的难电离的物质有H2O、CH3COOH、H2CO3、NH3·H2O
生成挥发性的物质:常见易挥发性物质有CO2、SO2、NH3等
发生氧化还原反应:遵循氧化还原反应发生的条件。
 定义:在化学反应过程中放出或吸收的热量;
定义:在化学反应过程中放出或吸收的热量;
符号:△H
单位:一般采用KJ·mol-1
测量:可用量热计测量
研究对象:一定压强下在敞开容器中发生的反应所放出或吸收的热量。
 反应热: 表示方法:放热反应△H<0,用“-”表示;吸热反应△H>0,用“+”表示。
反应热: 表示方法:放热反应△H<0,用“-”表示;吸热反应△H>0,用“+”表示。
燃烧热:在101KPa下,1mol物质完全燃烧生成稳定氧化物时所放出的热量。
 定义:在稀溶液中,酸跟碱发生反应生成1molH2O时的反应热。
定义:在稀溶液中,酸跟碱发生反应生成1molH2O时的反应热。
中和热:强酸和强碱反应的中和热:H+(aq)+OH-(aq)=H2O(l); △H=-57.3KJ·mol-
弱酸弱碱电离要消耗能量,中和热 |△H|<57.3KJ·mol-1
 原理:断键吸热,成键放热。
原理:断键吸热,成键放热。
 反应热的微观解释:反应热=生成物分子形成时释放的总能量-反应物分子断裂时所吸收的总能量
反应热的微观解释:反应热=生成物分子形成时释放的总能量-反应物分子断裂时所吸收的总能量
 定义:表明所放出或吸收热量的化学方程式。
定义:表明所放出或吸收热量的化学方程式。
意义:既表明化学反应中的物质变化,也表明了化学反应中的能量变化。
 热化学
①、要注明反应的温度和压强,若反应是在298K,1atm可不注明;
热化学
①、要注明反应的温度和压强,若反应是在298K,1atm可不注明;
方程式 ②、要注明反应物和生成物的聚集状态或晶型;
书写方法 ③、△H与方程式计量数有关,注意方程式与△H对应,△H以KJ·mol-1单位,化学计量数可以是整数或分数。
④、在所写化学反应方程式后写下△H的“+”或“-”数值和单位,方程式与△H之间用“;”分开。
盖斯定律:一定条件下,某化学反应无论是一步完成还是分几步完成,反应的总热效应相同。
|
分解反应 AB=A+B

 置换反应
A+BC=C+AB
置换反应
A+BC=C+AB
|

 氧化还原反应 概念、特征、本质、分析表示方法、应用
氧化还原反应 概念、特征、本质、分析表示方法、应用

|
 化学反应:
非氧化还原反应
化学反应:
非氧化还原反应
 离子反应
离子反应
 本质、特点、分类、发生的条件
本质、特点、分类、发生的条件

|

 放热反应 热化学反应方程式
放热反应 热化学反应方程式
 吸热反应 燃烧热
吸热反应 燃烧热
中和热
物质的量
 ①、定义:表示含有一定数目粒子的集体。
①、定义:表示含有一定数目粒子的集体。
②、符号:n
 物质的量 ③、单位:摩尔、摩、符号mol
物质的量 ③、单位:摩尔、摩、符号mol
④、1mol任何粒子(分、原、离、电、质、中子)数与0.012kg12C中所含碳原子数相同。
⑤、、架起微观粒子与宏观物质之间联系的桥梁。
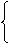 ①、定义:1mol任何粒子的粒子数叫阿伏加德罗常数。
①、定义:1mol任何粒子的粒子数叫阿伏加德罗常数。
阿伏加德罗常数: ②、符号NA
③、近似值:6.02×1023
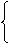 ①、定义:单位物质的量气体所占的体积叫~
①、定义:单位物质的量气体所占的体积叫~
 基本概念 气体摩尔体积:②、符号:Vm
基本概念 气体摩尔体积:②、符号:Vm
③、单位:L·mol-1
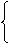 ①、定义:单位物质的量物质所具有的质量叫~
①、定义:单位物质的量物质所具有的质量叫~
摩尔质量:②、符号:M ③、单位:g·mol-1或kg·mol-1
④、若以g·mol-1为单位,数值上与该物质相对原子质量或相对分子质量相等。

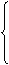 ①、定义:单位体积溶液中所含溶质B的物质的量来表示溶液组成的物理量叫溶质B的物质的量浓度。
①、定义:单位体积溶液中所含溶质B的物质的量来表示溶液组成的物理量叫溶质B的物质的量浓度。
物质的量浓度:②、符号:c(B)
③、单位:mol·L-1
 ①、定律:在相同温度和压强下,相同体积的作何气体都含有相同数目的分子。
①、定律:在相同温度和压强下,相同体积的作何气体都含有相同数目的分子。
 同温同压下:
同温同压下:
|

同温同体积下:
 Ⅰ、气体休的密度和相对密度:
Ⅰ、气体休的密度和相对密度:
标况下:
|

Ⅱ、摩尔质量M(或平均摩尔质量 )
)
M=22.4L·mol-1×ρ,
 =M(A)ф(A)+M(B)ф(B)+··· ф为体积分数。
=M(A)ф(A)+M(B)ф(B)+··· ф为体积分数。
 ①、以物质的量为中心的有关物理量的换算关系:
①、以物质的量为中心的有关物理量的换算关系:
物质所含粒子数N

|

|

|
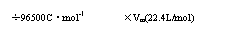
|

|
 电量(C)
气体的体积(标准状况)
电量(C)
气体的体积(标准状况)
|
|

|

|

溶液的物质的量浓度CA)

②、物质的量与其它量之间的换算恒等式:

③、理想气体状态方程(克拉伯龙方程):
PV=nRT 或
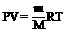 (R=8.314J/mol·K)
(R=8.314J/mol·K)
④
|



 微粒的大小
1mol固、液体的体积
微粒的大小
1mol固、液体的体积
|

 物质体积
微粒的个数
1mol物质的体积
物质体积
微粒的个数
1mol物质的体积
 |
|||
|
|||

 微粒之间距离
1mol气体的体积
微粒之间距离
1mol气体的体积
 ①、溶液稀释定律:溶质的量不变,m(浓)·w(浓)= m(稀)·w(稀);c(浓)·V(浓)=c(稀)·V(稀)
①、溶液稀释定律:溶质的量不变,m(浓)·w(浓)= m(稀)·w(稀);c(浓)·V(浓)=c(稀)·V(稀)
|

③、溶解度与物质的量浓度的换算:
④、质量分数与物质的量浓度的换算:
 ⑥、一定物质的量浓度 主要仪器:量筒、托盘天平(砝码)、烧杯、玻璃棒、胶头滴管、容量瓶
⑥、一定物质的量浓度 主要仪器:量筒、托盘天平(砝码)、烧杯、玻璃棒、胶头滴管、容量瓶
溶液的配配制: 方法步骤:计算→称量→溶解→转移→洗涤→振荡→定容→摇匀→装瓶
识差分析:关键看溶质或溶液体积的量的变化。依据 来判断。
来判断。
物质结构 元素周期律
|

 中子N(不带电荷)
同位素 (核素)
中子N(不带电荷)
同位素 (核素)

 原子核
→ 质量数(A=N+Z)
近似相对原子质量
原子核
→ 质量数(A=N+Z)
近似相对原子质量
 质子Z(带正电荷) → 核电荷数
元素 → 元素符号
质子Z(带正电荷) → 核电荷数
元素 → 元素符号


 原子结构 :
最外层电子数决定主族元素的
决定原子呈电中性
原子结构 :
最外层电子数决定主族元素的
决定原子呈电中性

 电子数(Z个):
电子数(Z个):
化学性质及最高正价和族序数
 体积小,运动速率高(近光速),无固定轨道
体积小,运动速率高(近光速),无固定轨道
核外电子 运动特征
|
 电子云(比喻) 小黑点的意义、小黑点密度的意义。
电子云(比喻) 小黑点的意义、小黑点密度的意义。
 排布规律
→ 电子层数
周期序数及原子半径
排布规律
→ 电子层数
周期序数及原子半径
表示方法 → 原子(离子)的电子式、原子结构示意图
 随着原子序数(核电荷数)的递增:元素的性质呈现周期性变化:
随着原子序数(核电荷数)的递增:元素的性质呈现周期性变化:
①、原子最外层电子数呈周期性变化
 元素周期律 ②、原子半径呈周期性变化
元素周期律 ②、原子半径呈周期性变化

 ③、元素主要化合价呈周期性变化
③、元素主要化合价呈周期性变化
④、元素的金属性与非金属性呈周期性变化

 ①、按原子序数递增的顺序从左到右排列;
①、按原子序数递增的顺序从左到右排列;

 元素周期律和
排列原则
②、将电子层数相同的元素排成一个横行;
元素周期律和
排列原则
②、将电子层数相同的元素排成一个横行;
元素周期表 ③、把最外层电子数相同的元素(个别除外)排成一个纵行。

 ①、短周期(一、二、三周期)
①、短周期(一、二、三周期)

 周期(7个横行) ②、长周期(四、五、六周期)
周期(7个横行) ②、长周期(四、五、六周期)
周期表结构 ③、不完全周期(第七周期)
 ①、主族(ⅠA-ⅦA共7个)
①、主族(ⅠA-ⅦA共7个)
元素周期表 族(18个纵行) ②、副族(ⅠB-ⅦB共7个)
③、Ⅷ族(8、9、10纵行)
④、零族(稀有气体)
 同周期同主族元素性质的递变规律
同周期同主族元素性质的递变规律
①、核电荷数,电子层结构,最外层电子数
②、原子半径
性质递变 ③、主要化合价
④、金属性与非金属性
⑤、气态氢化物的稳定性
⑥、最高价氧化物的水化物酸碱性
 电子层数: 相同条件下,电子层越多,半径越大。
电子层数: 相同条件下,电子层越多,半径越大。
 判断的依据 核电荷数 相同条件下,核电荷数越多,半径越小。
判断的依据 核电荷数 相同条件下,核电荷数越多,半径越小。
最外层电子数 相同条件下,最外层电子数越多,半径越大。
 微粒半径的比较
1、同周期元素的原子半径随核电荷数的增大而减小(稀有气体除外)如:Na>Mg>Al>Si>P>S>Cl.
微粒半径的比较
1、同周期元素的原子半径随核电荷数的增大而减小(稀有气体除外)如:Na>Mg>Al>Si>P>S>Cl.
26.(8分)为了预防碘缺乏病,国家规定每千克食盐中应含有40 mg~50 mg KIO3。为检验某种食盐是否为加碘的合格食盐,某同学取食盐样品428 g,设法溶解出其中全部的KIO3,将溶液酸化并加入足量的KI淀粉溶液,溶液呈蓝色,再用0.030 mol·L-1的硫代硫酸钠溶液滴定,用去18.00 mL时蓝色刚好褪去。试通过计算说明该加碘食盐是否为合格产品。有关反应如下:
IO +5I-+6H+====3I2+3H2O
+5I-+6H+====3I2+3H2O
I2+2S2O ====2I-+S4O
====2I-+S4O
25.(8分)今有FeCl2、CuCl2混合溶液400 mL,经测定其中c(Cl-)为a mol·L-1,投入足量的锌粉b g,充分反应后过滤,所得固体残渣经洗涤干燥后,质量为c g,求原混合溶液中Fe2+、Cu2+的物质的量浓度。(只考虑金属与盐的完全反应)
24.(12分)1,4-丁二醇是生产工程塑料PBT(聚对苯二甲酸丁二酯)的重要原料,它可以通过下图两种不同的合成路线制成,请写出序号物质的结构简式。

① ② ③ ④
⑤ ⑥ ⑦ ⑧
23.(11分)据报道,目前我国结核病的发病率有抬头的趋势。抑制结核杆菌的药物除雷米封外,PAS-Na(对氨基水杨酸钠)也是其中一种。它与雷米封同时服用,可以产生协同作用。
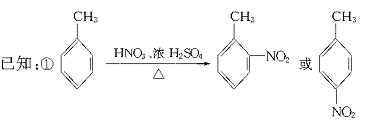
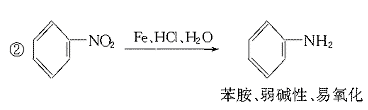



(1)写出下列反应的化学方程式:

(2)写出下列物质的结构简式:C. ,D.
(3)指出反应类型:Ⅰ ,Ⅱ ,Ⅲ
22.(6分)1998年Murad等三位教授因研究NO分子在人体内的独特功能而获诺贝尔奖。
(1)NO对环境的危害在于 。
A.破坏臭氧层 B.形成酸雨
C.高温下能使一些金属被氧化 D.与人体的血红蛋白结合
(2)在含Cu+的酶的活化中心中,亚硝酸根离子可转化为NO,写出Cu+和亚硝酸根离子在酸性溶液中反应的离子方程式 。
(3)常温下把NO气体压缩到100个大气压,在一个体积固定的容器内加热到50℃,发现气体压强迅速下降,降至略小于原压强的 就不再改变 ,已知产物之一为N2O,写出上述变化的化学方程式
。
就不再改变 ,已知产物之一为N2O,写出上述变化的化学方程式
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com