
题目列表(包括答案和解析)
8.已知31g白磷变成红磷放出18.39kJ热量,下列两反应中,Q1和Q2的关系是
4P(白、s)+5O2(g)=2P2O5(s),△H=Q1kJ/mol
4P(红、s)+5O2(g)=2P2O5(s),△H=Q2kJ/mol
A.Q1>Q2 B.Q1=Q2 C.Q1<Q2 D.无法确定
13.(10分)由SiO2和CaCO3组成的混合物26.0 g,经灼烧至质量恒定时,其质量减少8.8 g,试解答:
(1)写出可能发生反应的化学方程式;
(2)求产生的气体在标准状况下的体积;
(3)求原混合物中SiO2的质量。
12.(10分)由Fe、Si、Al组成的混合物9.7 g,与足量的稀硫酸反应,在标准状况下可生成5.6 L氢气。若将等质量的该混合物与足量氢氧化钠溶液反应,在标准状况下也可产生同样多的氢气。问在上述9.7 g混合物中含Fe、Si、Al各多少克?
11.(10分)普通玻璃的成分Na2CaSi6O14,以氧化物形式可表示为 ,钾云母的化学式是K2H4Al6Si6O24,以氧化物形式可表示为 。
10.(10分)氮化硅是一种耐高温陶瓷材料,它的硬度大,熔点高,化学性质稳定,工业上曾普遍采用高纯硅与纯氮在1300℃反应获得。
(1)氮化硅晶体属于 晶体。
(2)已知氮化硅晶体结构中,原子间都以单键相连,且N原子和N原子,Si原子和Si原子不直接相连,同时每个原子都满足8电子稳定结构,请写出氮化硅的化学式 。
(3)现用四氯化硅和氮气在氢气保护下,加强热发生反应,可得较高纯度的氮化硅,反应的化学方程式为: 。
9.(12分)将5 g含有SiO2的石灰石与267 mL 0.5 mol·L-1的盐酸反应,所得CO2在标准状况下的体积为1064 mL。
(1)中和剩余的盐酸,需1 mol·L-1 NaOH溶液 mL。
(2)煅烧1吨这种不纯的碳酸钙,最后残留物质量为 吨。
8.下列叙述中,不正确的是
A.光导纤维广泛应用于现代通讯,制造光导纤维的主要原料是SiO2
B.二氧化碳不宜用于扑灭金属钠燃烧引起的火灾
C.一定条件下,可将石墨转化为金刚石,这一变化是物理变化
D.氢气作为新型燃料,其突出的优点是氢气轻,便于携带
7.现有下列五个转化,其中不可能通过一步反应实现的是
①SiO2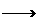 Na2SiO3
Na2SiO3
②CuSO4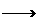 CuCl2
CuCl2
③SiO2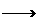 H2SiO3
H2SiO3
④CuO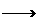 Cu(OH)2
Cu(OH)2
⑤Ca3(PO4)2 Ca(H2PO4)2
Ca(H2PO4)2
A.①和② B.③和④
C.②③和④ D.②③④和⑤
6.欲除去SiO2中混有的少量CaCO3和Fe2O3,最好应加入的试剂是
A.硫酸 B.烧碱
C.氢氟酸 D.盐酸
5.下列各组物质的比较中,正确的是
A.熔点:晶体硅>碳化硅>金刚石
B.金属活动性:锗>锡
C.稳定性:CH4>SiH4
D.酸性:H2SiO3>H2CO3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com