
题目列表(包括答案和解析)
29.(12分)某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
(1)该反应的化学方程式为 。
(2)反应开始至2min,气体Z的平均反应速率为 。
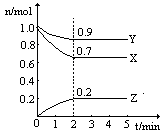
(3)若X、Y、Z均为气体,反应达平衡时:
①此时体系的压强是开始时的 倍。
②若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将降低(容器不与外界进行热交换),则该反应为 反应(填“放热”或“吸热”);达新平衡时,容器内混合气体的平均分子量比原平衡时 (填增大、减小或相等)。
(4)此反应达平衡后,若只加大体系压强,Z的物质的量减少,若Y是气体,则X的聚集状态是 。
15.用pH大小表示溶液的酸碱性相对强弱有许多不足之处。因此,荷兰科学家Henk Van Lubeck引入了酸度(AG)的概念,即把电解质溶液中的酸度定义为c(H+)与c(OH一)比值的对数,用公式表示为AG=lg [c(H+)/ c(OH一)] 。常温下,在AG=10的溶液中能大量共存的离子是
A.Ca2+、K+、Cl-、SO32- B.NH4+、Fe2+、 I一、SO42-
C.Na+ 、K+、ClO-、S2- D.Na+、S2O32-、AlO2-、K+
14.在有乙离子存在的情况下,欲用试剂丙来检验溶液中是否含有甲离子,下表所加试剂丙能够对甲离子进行成功检验的是:(说明:在实验过程中不允许加热、过滤、萃取等操作)
|
选项 |
试剂丙 |
甲离子 |
乙离子 |
|
A |
稀盐酸、Ba(NO3)2溶液 |
SO42- |
SO32- |
|
B |
AgNO3溶液 |
Cl- |
I- |
|
C |
KSCN溶液 |
Fe2+ |
Fe3+ |
|
D |
稀氨水 |
Al3+ |
Ag+ |
13.某温度下,w g某物质在足量氧气中充分燃烧,其燃烧产物立即与过量的Na2O2反应,固体质量增加w g。在①H2②CO ③CO和H2的混合气 ④HCHO ⑤CH3COOH
⑥HO-CH2-CH2-OH中,符合题意的是
A.均不符合 B.只有①②③ C.只有④⑤ D.全部符合
12.在一密闭烧瓶中注入NO2,在25℃时建立下列平衡:2NO2  N2O4;△H<0。若把烧瓶置于100℃的沸水中,下列情况:①颜色②气体的相对平均分子质量③质量④压强⑤密度中不变的是
N2O4;△H<0。若把烧瓶置于100℃的沸水中,下列情况:①颜色②气体的相对平均分子质量③质量④压强⑤密度中不变的是
A.③④ B.③⑤
C.②④ D.①③
11. 分析右面的能量变化示意图,确定下列选项中正确的是
A.2 A(g)+ B(g)=2 C(g); △H<0
B.2 A(g)+ B(g)=2 C(g); △H>0
C.2 A + B=2 C;△H<0
D.2 C=2 A +B ;△H<0
10.一定条件下,AL密闭容器中放入1mol N2和3mol H2,发生N2+3H2 2NH3的反应,下列选项中能说明反应已达到平衡状态的是
2NH3的反应,下列选项中能说明反应已达到平衡状态的是
A.c(N2):c(H2):c(NH3)=1:3:2
B.v(N2)=3v(H2)
 C.单位时间内1个N≡N键断裂的同时,有6个N-H键断裂
C.单位时间内1个N≡N键断裂的同时,有6个N-H键断裂
D.单位时间消耗0.1molN2的同时,生成0.2molNH3
9.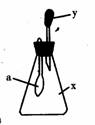 如图所示,锥形瓶中盛有气体x,滴管内盛有液体y。若挤压滴管胶头,使液体y滴入瓶中,振荡,过一会可见小气球a鼓气。气体x和液体y不可能是
如图所示,锥形瓶中盛有气体x,滴管内盛有液体y。若挤压滴管胶头,使液体y滴入瓶中,振荡,过一会可见小气球a鼓气。气体x和液体y不可能是
A.x又是NH3,y是水 B.x是SO2,y是NaOH浓溶液
C.x是CO2,y是稀H2SO4 D.是HCl,y是NaNO3稀溶液
8.设NA为阿伏加德罗常数,下列说法正确的是
A.6.2 g白磷分子中含P-P键数为0.05NA
B.1 mol CH+3含电子数为8 NA
C.标准状况下22.4 L SO3中含原子数为4 NA
D.常温常压下11.2 L CO2气体通过足量Na2O2充分反应,转移电子数为2 NA
32.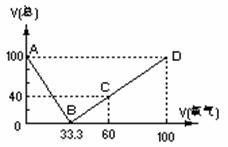 (20分)在标准状况下,将100mLH2S和O2混合气体点燃反应后恢复到原状况,发现随 混和气体中O2所占的体积V氧气的变化,反应后所得气体的总体积V总也不同,其关系式如下图所示(气体体积均在同温同压下测定)。请回答下列问题:
(20分)在标准状况下,将100mLH2S和O2混合气体点燃反应后恢复到原状况,发现随 混和气体中O2所占的体积V氧气的变化,反应后所得气体的总体积V总也不同,其关系式如下图所示(气体体积均在同温同压下测定)。请回答下列问题:
(1)写出图中B、C两点处的化学反应方程式: B点的反应: ;

C点的反应: 。
(2)通过对图像的分析得出:
①当V总>40mL、②V总<40mL、③V总=40mL时气体的成分:
|
|
AB段 |
BD段 |
|
①V总>40mL |
|
|
|
②V总<40mL |
|
|
|
③V总=40mL |
|
|
(3) 当V总=25mL时,求原混合气体中H2S和O2的体积各多少mL?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com