
题目列表(包括答案和解析)
3. 下列八种工业生产,可直接用到石灰石的是( )
① 炼铁 ② 炼钢 ③ 制硅酸盐水泥 ④ 制普通玻璃
⑤ 制漂白粉 ⑥ 制电石 ⑦ 制波尔多液 ⑧ 制过磷酸钙肥料
(A) ①②③④ (B) ①③④⑥
(C) ①③④⑤ (D) ②③④⑧
2. 下列微粒的空间结构呈正四面体,但键角不是109 度28分的是( )
(A) 白磷P4 (B) 四氯化碳CCl4
(C) 铵根离子 NH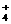 (D) 磷化氢PH3
(D) 磷化氢PH3
每小题只有一个选项符合题意。
可能用到的原子量:
H 1 He 4 C12 N 14 O 16 Na 23
Mg24 Al 27 S32 Cl35.5 Zn 65
1. 工业上制取镁粉的方法是将镁的蒸气进行冷却,其中下列最适宜的方法是( )
(A) 在氮气的容器内冷却
(B) 在水中冷却
(C) 在氢气中冷却
(D) 在二氧化碳气体里冷却
23.(4分)已知下列两个热化学方程式;
H2(g)+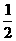 O2(g)==== H2O(l ); △H= -285.8kJ/ mol
O2(g)==== H2O(l ); △H= -285.8kJ/ mol
C3H8(g)+5O2(g) ==== 3CO2(g) +4H2O(l) ; △H= -22220.0 kJ/ mol
(1)实验测得H2和C3H8的混合气体共5mol,完全燃烧生成液态水时放热5297.4kJ,则混合气体中H2和C3H8的体积比是 。
(2)已知:H2O(l)=H2O(g);△H=+44.0 kJ/ mol
试写出丙烷燃烧生成CO2和水蒸气热化学方程式。
22.(7分)某无色溶液可能是由Na2CO3、NaOH、MgCl2、AlCl3、BaCl2、Fe(SO4)3、
(NH4)2 SO4溶液中的两种或两种以上混合而成。取该溶液,向其中加入稀硫酸,有白色沉淀生成;继续加入稀硫酸,沉淀又完全消失,整个实验过程中无气体产生。
(1)原溶液是由 和 溶液混合而成的。
(2)整个实验过程中,有关反应的离子方程式是 、 、
。
21.(6分)配平下列离子方程式,并回答问题:
 (1)
Fe(OH)3+ ClO- + OH---
FeO4n-+
Cl-+
(1)
Fe(OH)3+ ClO- + OH---
FeO4n-+
Cl-+
H2O
(2)若有3.21gFe(OH)3参加反应,共转移了5.42×102个电子,则n= ,FeO4n-中铁的化合价为 。
(3)试推测FeO4n-能与下列哪些物质反应(填序号) 。
A.Cl2 B.SO2 C.H2S D.O2
19.(8分)氯碱厂电解饱和食盐水制取NaOH的工艺流程示意示图如下:
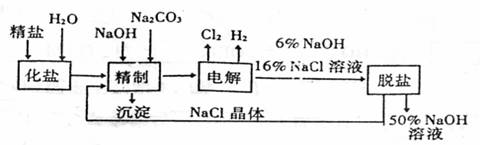
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生的电极反应式为 ,
与电源负极相连的电极附近,溶液的pH (填“升高”、“降低”或“不变”)。
(2)为有效除去粗盐中含有的Ca2+、Mg2+和SO42+,供选用的试剂有BaCl2、Ba(NO3)2、KOH、NaOH、K2CO3、Na2CO3,应选用的试剂及其加入的正确顺序是 。
(3)在用离子交换膜法电解食盐水时,阳离子交换膜将电解槽分隔为阳极室和阴极室的目的是 、
。采用无隔膜电解冷食盐水时,Cl2与NaOH充分接触,产物只有NaClO和H2,则电解反应的化学方程式为 。
16.如图所示,x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色
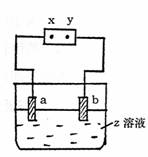 无臭气体放出,下列组合符合这一情况的是 ( )
无臭气体放出,下列组合符合这一情况的是 ( )
|
第Ⅱ卷(非选择题 共49分)
15.下列实验操作方法正确的是 ( )
A.在试管中加入2mL10%的CuSO4溶液,然后加入4至6滴10%的NaOH溶液振荡、
再加入几滴乙醛溶液加热煮沸,可以检验乙醛分子中的醛基
B.测定CuSO4晶体结晶水含量时,当灼烧晶体至全部变为白色粉末后,露置在空气中
冷却至室温称取其质量
C.用氢氧化钠溶液清洗盛过苯酚的试管
D.向溴乙烷中滴加硝酸酸化的AgNO3溶液,以检验其中的溴元素
14.在水中加入等物质的量的Ag+、Pb2+、Na+、SO42-、NO3-、Cl-,用惰性电极电解此溶液,
通电片刻,则氧化产物与还原产物的质量比为 ( )
A.35.5:10.8 B.16:207 C.8:1 D.108:35.5
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com