
题目列表(包括答案和解析)
26、滴定度是指每毫升标准溶液相当于被测定物质的克数,通常用g/ml表示。例如,标准硫酸溶液滴定氢氧化钾溶液的滴定度为0.056g/ml,表示每毫升某标准硫酸溶液恰好与0.056g氢氧化钾完全反应。(将答案填入横线上,不必写计算过程。)
⑴某标准盐酸溶液对碳酸钙的滴定度为0.05g/ml,该盐酸溶液的PH为_______。
⑵某不纯的硝酸银样品中Ag+的质量分数a,取一定质量的该样品溶于水,并用上述盐酸滴定到终点,恰好消耗盐酸aml ,则该盐酸对该硝酸银样品的滴定度为_____________。
⑶某碳酸钠样品中可能混有氢氧化钠或硫酸氢钠,若以酚酞为指示剂(该指示剂变色范围为PH8-10),仍用以上标准盐酸溶液滴定,已知盐酸对碳酸钠样品的滴定度为0.073g/ml,试通过计算确定该样品中碳酸钠的纯度: _____________。
25、24.42g表面已形成铜绿[Cu2(OH)2CO3]的铜片与足量稀盐酸反应,生成标况下的CO2 224mL。
①写出有关反应的离子方程式。
②求原铜片中铜单质的质量分数。(保留三位有效数字)
24、已知重铬酸钾(K2Cr2O7)可与浓盐酸反应生成Cl2、CrCl3、KCl和水。
⑴请写出并配平上述反应的化学方程式。________________________________
⑵此反应中浓盐酸显示的性质为_______(从下列项中选择填空)
A、氧化性 B、还原性 C、酸性
⑶此反应的离子反应方程式可表示为(K2Cr2O7、CrCl3均为易溶于水,易电离的盐)_________________________________________________
⑷将上述反应产生的Cl2通入盛有足量NH3的集气瓶,反应剧烈,并产生大量白烟(发生置换反应)试写出有关反应的化学方程式_____________ 。
⑸在上述反应过程中,若反应消耗K2Cr2O70.2mol,产生的Cl2在⑷反应中最多消耗的NH3为___________mol。
23、在一定条件下,不许添加别的反应物,经不同的化学反应,可实现如下图的各种变化。其中,反应③、④、⑤属氧化还原反应,而反应①、②属非氧化还原反应。X、F和Y为单质(其余为化合物),且B是无毒气体,F是空气的主要成分之一,Z中阴、阳离子电子层结构相同,据此填空。

(1)物质A是: ;F是: ;X是: 。Y是: 。
(2)写出反应②的化学方程式: 。
(3)写出反应④的化学方程式: 。
22、某酸HX和某碱MOH,25℃下两溶液的pH之和等于a。
⑴若HX为强酸,MOH为强碱,等体积混合后,pH<7,则a________14(填=,>或<)
⑵若HX为强酸,MOH为弱碱,等体积混合后,若a=14,则混合后溶液的pH__________7(填=,>或<)
⑶25℃下,若要使由水电离出的 C(H+)>1×10-7mol·L-1,应采取的措施是__________(填字母)。
A、加入 明矾 B、加入NaHSO4 C、加入Na2O
D、加入Na2CO3 E、通入CO2 F、通入NH3
21、已知:(CH3)2CHCOOR CH2=C(CH3)COOR
RCH=CH2
CH2=C(CH3)COOR
RCH=CH2 RCH(CH3)CHO
今有A、B、C、D、E、F六种有机物,它们所含的元素不超过C、H、O三种,这六种有机物的转化关系如下:
A
RCH(CH3)CHO
今有A、B、C、D、E、F六种有机物,它们所含的元素不超过C、H、O三种,这六种有机物的转化关系如下:
A B
B C®D
C®D E
E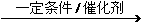 F
其中A和D摩尔质量分别是82g/mol和202g/mol。A是无支链的烃;B可发生银镜反应;C可被碱中和;D无酸性;而F是高分子化合物,其化学式是(C10H14O4)n。试回答:
(1)结构简式:A:
F
其中A和D摩尔质量分别是82g/mol和202g/mol。A是无支链的烃;B可发生银镜反应;C可被碱中和;D无酸性;而F是高分子化合物,其化学式是(C10H14O4)n。试回答:
(1)结构简式:A:
E: 。 (2)反应类型:C®D是 ;E®F是 。 (3)化学方程式:B与足量新制的Cu(OH)2悬浊液在加热时反应:
。
20、下面a~f是中学化学实验中常见的几种仪器:
a.量筒 b.容量瓶 c.试管 d.圆底烧瓶 e.滴定管 f.托盘天平
⑴其中要标示出仪器具体使用温度的是___________(填写编号);
⑵可用作反应器并能进行加热的是____________(填写编号);
⑶用已知浓度的稀烧碱溶液滴定未知浓度的稀盐酸溶液,若滴定前平视读数,滴定终点时俯视读数。所测定的盐酸浓度结果_________(填:“偏大”、“偏小”、“正确”)
19、图(I)中瓶a内放入20毫升6摩/升盐酸,b是未充气的气球,里边放有4克碳酸钙粉末,将它紧紧套在瓶a口上,胶管c套在瓶的侧口,并用弹簧夹d夹紧(瓶口和侧口都不漏气)。将图(I)的装

置在托盘天平上称量,质量为W1克。
根据实验现象填写下列空白:
(1)把气球b中的碳酸钙粉末小心地倒入
瓶中,立即产生许多气泡,气球逐渐
胀大(图II)。反应结束后,再次称量,
质量为W2克。则W2和W1的关系
是 。
(2)取25毫升6摩/升NaOH溶液。先用滴管取少量NaOH溶液,滴管插入胶管c口(为便于操作,可以适当倾斜瓶a,注意防止漏气)。打开d,将溶液挤入瓶中,立即夹紧d。可以看到瓶内产生少量白色沉淀,轻轻摇动瓶a,沉淀随即消失。用同样方法再加入少量NaOH溶液,又产生白色沉淀,轻摇,沉淀又消失。使沉淀消失的反应的化学方程式是 。
(3)将全部NaOH溶液很快加入瓶中,夹紧d,瓶内产生大量白色沉淀,不再溶解,此时瓶内温度 (填 “ 不变”、“降低”或“升高”)。
(4)继续轻摇瓶a,气球逐渐缩小,直至恢复反应前的下垂状。写出这时发生的反应的化学方程式。 。
18、下列操作正确的是: ( )
A、金属钠密封保存在冷水中
B、用二硫化碳清洗沾有红磷的试管
C、用适量苯和液溴混合制溴苯时,只需加铁屑,不必加热
D、在制取乙酸乙酯的实验中,将导管伸进饱和碳酸钠溶液
17、N、M两种元素,已知N是短周期元素,且N2-与M+的电子数之差为8,则下列说法正确的是: ( )
A、N和M原子的电子总数之和可能为11
B、N和M的原子序数之差为8
C、N和M原子的最外层电子数之和为8
D、N和M原子的最外层电子数之差为7
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com