
题目列表(包括答案和解析)
21. 甲、乙两个电解池均以Pt为电极,且互相串联,甲池盛有AgNO3溶液,乙池中盛有一定量的某盐溶液,通电一段时间后,测得甲池电极质量增加2.16g,乙池电极析出0.24g金属,则乙池中的溶质可能是
(A)CuSO4 (B)MgSO4 (C)Al(NO3)3 (D)Na2SO4
20. 已知氟化氢气体中有平衡关系:
2H3F3 = 3H2F2 - Q, H2F2 = 2HF –Q
下面有关叙述不正确的是
(A) 若气体的平均摩尔质量为40g/mol则H3F3的体积分数约为10%
(B) 若气体的平均摩尔质量为42g/mol则H3F3的体积分数小于10%
(C) 定温定容时,向题述平衡体系中充入HF气,则H3F3与HF的浓度比,数值加大
(D) 定温定容下,向题述平衡体系中充入H3F3气,则H3F3与HF的浓度比,数值加大
19. 以铂为电极电解1L 0.5mol/L AgNO3溶液,在电路上通过0.1mol电子后,改变两个电极,电路上又通过0.2mol电子,则电解后溶液中Ag+、H+、NO3-物质的量分别为
(A) 0.2、0.2、0.5 (B)0.3、0.2、0.5
(C) 0.1、0.1、0.1 (D)无法计算
18. 常温下,一定浓度的NaOH溶液和一定浓度的醋酸钠溶液中水的电离度之比为10-7,则这两溶液的pH之和为
(A) 14 (B) 15 (C) 21 (D) 22
17. 下列操作一定能制得胶体的是
(A) 等物质的量浓度的KI溶液和AgNO3溶液混合
(B) 向50mL蒸馏水中滴加饱和FeCl3 溶液
(C) 向50mL蒸馏水中加入大量淀粉
(D) 向10mL 1mol/L盐酸中加入1mL水玻璃,并用力振荡
16. 1L 0.1mol/L的AgNO3溶液在以Ag作阳极,Fe作阴极的电解槽中电解,当阴极上增重2.16g时,下列判断正确的是
(A) 电解质溶液的浓度变为0.08mol/L
(B) 阳极上产生112mLO2(标况)
(C) 转移12.04x1021个电子
(D) 反应中有0.02mol的物质被氧化
15. 某温度下重水中存在如下平衡:D2O = D+ + OD-,D2O的离子积常数为1.0x10-12,若pD= -lg[D+],该温度下有关分析正确的是
(A) 0.1molNaOD溶于重水制成1L溶液,pD = 13
(B) 将pD = 4的DCl的重水溶液稀释100倍,所得溶液pD = 6
(C ) 向30mL 0.5mol/LNaOD的重水溶液稀释100倍,所得溶液的pD=6
(D) pD=10的NaOD的重水溶液中,由重水电离出的[OD-]为1x10-10mol/L
15.Na2CO3溶液中,存在多种分子和离子,下列关系式中正确的是
(A)[OH-]=[HCO3-] + [H+] + 2[H2CO3]
(B)[OH-] = [HCO3-] + [H+] + [H2CO3]
(C)[Na+] > [CO32-] > [HCO3-] > [OH-] > [H+]
(D) [Na+] > [CO32-] > [OH-] > [HCO3-] > [H+]
14. 与金属铝反应只能放出氢气,且一定能大量共存的离子组是
(A)NH4+、NO3-、CO32-、Na+ (B)Na+、Ba2+、Cl-、SO42-
(C)NO3-、K+、Cl-、Na+ (D)AlO2-、K+、OH-、Al3+
13. 下列离子方程式书写正确的是:
(A) 等体积、等物质的量浓度的Ca(OH)2溶液与NaHCO3溶液混合
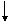 Ca2+ + 2OH-
+ 2HCO3- = CaCO3 + CO32- + H2O
Ca2+ + 2OH-
+ 2HCO3- = CaCO3 + CO32- + H2O
(B) 向10mL0.1mol/L的溴化亚铁溶液中滴入少量氯水(0.09mol/L)
2Fe2+ + 4Br- + 3Cl2 == 2Fe3+ + 2Br2 + 6Cl-
(C) Ba(HCO3)2溶液与足量NaOH溶液混合:
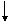 Ba2+ + HCO3- + OH- = BaCO3 + H2O
Ba2+ + HCO3- + OH- = BaCO3 + H2O
(D) NH4HCO3溶液与足量NaOH 溶液混合
NH4+ + HCO3- + 2OH- == NH3.H2O + CO32- + H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com